A legionáriusbetegség
1976-ban, Philadelphiában az Amerikai Légió nagygyűlésén járványos tüdőgyulladás ütötte fel a fejét. Több mint kétszáz ember betegedett meg, és közülük harmincnégyen meg is haltak. A kór a legionáriusbetegség nevet kapta. Nem sokkal az eset után izolálták az addig ismeretlen kórokozót, amit a dallamos hangzású Legionella névre kereszteltek. A következő években a Legionella nemzetségbe számos újabb fajt soroltak be; a philadelphiai járványért a Legionella pneumophila volt a felelős. A kórokozó és a tünetek ismeretében egészen a második világháborúig visszamenőleg azonosítottak régebbi eseteket.
Világszerte elterjedt a betegség, eseteket jelentettek már Észak- és Dél-Amerikából, Afrikából, Európából és Ausztráliából. Az utóbbi években - többek között - Hollandiában, Ausztráliában, Spanyolországban és Angliában jelentkezett tömegesen a kór. Az Amerikai Egyesült Államokban a legionárius megbetegedések számát évenként 10-25 ezerre becsülik, amelyek nagy része szórványos eset, a járványok ritkák. Megbetegedések az év bármely szakában történhetnek, míg a járványok inkább nyáron vagy kora ősszel jellemzőek. Magyarországon minden évben 50-80 ilyen esetet jegyeznek fel.
A Legionella-baktériumok okozta tünetegyüttest legionellosisnak hívják, melynek kétféle klinikai formája létezik: a Pontiac-láz és a legionáriusbetegség. A Pontiac-láz (nevét az első, Michigan állam Pontiac nevű városában, 1968-ban lezajlott járvány után kapta): kevésbé súlyos lefolyású betegség, tüdőgyulladás (pneumónia) nem alakul ki, enyhe légúti panaszok, izomfájdalom, fejfájás, láz, rossz közérzet, esetleg köhögés, nátha jellemzik. A tünetek néhány órától 2-3 napig tartó lappangási idő után jelennek meg, majd néhány nap után a beteg általában magától gyógyul. Halálozás nincs.
A legionárius- (vagy légiós) betegség a fertőzés súlyosabb, tüdőgyulladással járó formája. A lappangási idő 2-10 nap. Jellemző tünetei: fejfájás, levertség, fáradékonyság, izomfájdalom, magas láz, hányás, száraz köhögés, nehéz légzés, mellkas- és hasfájdalom, esetleges hidegrázás. Érintett lehet az idegrendszer is, gyakori a depresszió, az aluszékonyság, a delírium, a tudatzavar. Komolyabb fertőzésekben előfordul, hogy a baktériumok a keringésbe is bejutnak, és így más szervek működését is megzavarják. Ekkor vesegyulladás, hasnyálmirigy-gyulladás, májkárosodás, szívizom- és szívbelhártya-gyulladás, hashártyagyulladás lehet a szövődmény. A halálozási arány 5-30 százalék.
Bármely életkorban megfertőződhetünk a kórokozótól, nagyobb arányban azonban a középkorú és idősebb embereket érinti. Bizonyos kockázati tényezők (dohányzás, alkoholizmus, szív-, tüdő-, vesebetegségek) hajlamosítanak a betegségre. Nagyobb a fertőzöttek aránya azok körében is, akiknek immunrendszere legyengült (egyes drogok, daganatok, AIDS, immunszupresszív terápia következtében).
Kórisme
A legionáriusbetegség nagyon hasonlít más tüdőbetegségekhez, ezért azoktól csupán a tünetek alapján elkülöníteni nagyon nehéz. Tüdőgyulladás kialakulhat gyógyszerek, fizikai, kémiai behatások, illetve autoimmun folyamatok következtében, az esetek legnagyobb részében azonban mikroorganizmusok okozzák. A kórokozók lehetnek paraziták, gombák, vírusok vagy - a leggyakrabban - baktériumok. A bakteriális esetek között a Streptococcuspneumoniae a listavezető, mögötte az ötödik helyen találhatók a Legionellák, a maguk néhány százalékos gyakoriságával. Legionáriusbetegség-gyanús tüdőgyulladásos megbetegedés esetén mindenképpen szükség van mellkasröntgenre, bizonyos hematológiai paraméterek mérésére és a Legionella-baktériumok jelenlétének kimutatását célzó laboratóriumi vizsgálatokra. A betegség meghatározására szolgáló eljárások közül egyesek csak hosszú idő után adnak eredményt, mások pedig nem állnak minden kórházi laboratórium rendelkezésére, ezért az orvosnak a megfelelő antibiotikum-terápia gyors kiválasztását sokszor a tüdőgyulladás kórokozójának pontos ismerete nélkül kell megtennie. Ebben nagy segítségére van számos egyéb információ, amelyek a beteg életkorával, kórtörténetével, hajlamosító tényezőivel stb. kapcsolatosak.
A Legionellák meghatározása. A kitenyésztés fertőzött szövetekből (köpetből, tüdőszövetből, vérből) történik. A Legionella-baktériumok laboratóriumi körülmények között viszonylag lassan nőnek, szelektív tenyésztáptalajt igényelnek speciális kiegészítőkkel és más fajok szaporodását akadályozó, növekedésgátló anyagokkal. A módszer előnye, hogy vele közvetlenül a kórokozó baktériumot sikerül kimutatni, 100 százalékban. Hátrányai, hogy a baktériumok lassú növekedése miatt több nap szükséges az eredményhez, és hogy kicsi az érzékenysége, azaz számos olyan, Legionellát hordozó betegből nem sikerül kitenyészteni a kórokozót, akik más - a továbbiakban bemutatandó - módszerekkel fertőzöttnek mutatkoztak.
DFA-vizsgálattal (direkt fluoreszcens antitestvizsgálat) a mintából közvetlenül a baktériumokat lehet kimutatni az egyes fajok elleni, szerocsoportokra specifikus, fluoreszcens antitestekkel. Gyorsan (kb. 1 óra alatt) eredményt szolgáltat és specifikussága csaknem 100 százalék. Kis hibalehetőséget az jelent, hogy nagyon ritkán más baktériumfajok is pozitív eredményt adnak. Hátrányai, hogy leginkább eszköz- és munkaigényes módszer, és az érzékenysége még mindig nem a legjobb.
A vizeletantigén-próba azon alapszik, hogy a fertőzöttek nagy része (de nem mindegyikük!) a betegség valamelyik szakaszában vizeletével Legionella-antigéneket ürít, amelyek többféle módszerrel kimutathatók. Igen érzékeny és specifikus eljárás, 1 órán belül eredményt ad. Az antigén hosszú időn keresztül ürülhet a vizelettel, ezért jelenlétének igazolása nem feltétlenül jelent akut infekciót.
Az antitest-kimutatás (szerológia) azon alapszik, hogy a fertőzés hatására a szervezet specifikus antitesteket kezd termelni a baktériumok ellen, amelyek kimutathatók a vérből. A módszer érzékeny és specifikus, bár néhány más baktériumfaj szintén pozitív eredményt adhat (álpozitív eredmény). A betegek egy részének szervezete azonban a fertőzés ellenére nem reagál olyan mértékű antitestszint-emelkedéssel, amely a pozitív eredmény kritériuma, így ezeket az eseteket ily módon nem lehet meghatározni. A módszer csak hetek múltán szolgáltat eredményt, így a tünetek akut kezelésében nincs az orvos segítségére.
A polimeráz láncreakció (angol nevének rövidítése: PCR) a molekuláris genetikai eljárások egyike, amely a Legionella-baktériumok specifikus DNS-szekvenciáinak kimutatását teszi lehetővé. A legújabb és talán legígéretesebb módszer. Alapja az, hogy a különböző betegmintákból (vér, köpet, légúti váladék) specifikusan felszaporíthatók a Legionellák DNS-ének egyedi szakaszai, ezáltal kimutatható mennyiség nyerhető belőlük. Nagyon érzékeny, már igen kis mennyiségű DNS jelenlétének kimutatására alkalmas. Specifikussága is kiváló; az eredmény néhány óra alatt megvan.
A betegség antibiotikumokkal kezelhető, a gyógyulás azonban lassú. Döntő fontosságú a terápia minél gyorsabb megkezdése. A legelterjedtebb, hatásos szer a legionellosisok ellen az erythromycin, amely egy, a prokariótasejtek fehérjeszintézisét gátló antibiotikum. Komolyabb esetekben rifampicinnel kombinálják. Az azithromycin szintén alkalmazható, mert hatékonyabbnak bizonyult és kevesebb a mellékhatása, mint az erythromycinnek.
Mit tudunk a Legionellákról?
A Legionella nemzetségbe jelenleg csaknem 50 faj mintegy 70 szerocsoportja tartozik. Közülük húsznál több faj emberi patogén, a megbetegedéseket legtöbbször a Legionellapneumophila 1-es szerocsoportja okozza (ennek a fajnak 15 szerocsoportja van). Ezek az aerob baktériumok pálcika alakúak, 1-2 csillójuk van, hosszuk 0,5-0,7 mm (1. ábra). Laboratóriumi tenyésztésük nehézkes, igényesek, számos kiegészítő anyag kell a táptalajukba, és így is csak lassan, több nap alatt hoznak miniatűrnyi telepeket. A természetben mindenütt előfordulnak: patakokban, tavakban, folyókban, egyéb felszíni vizekben, talajban és szennyvízben; a langyosabb, melegebb vizes környezetet részesítik előnyben. A Legionellák közös jellemzője, hogy az édesvízi egysejtűek sejten belüli élősködői. Néhány csillós egysejtű fajról és több mint egytucatnyi amőbafajról leírták már, hogy a Legionella-baktériumok gazdái. A baktériumok felvételre késztetik az egysejtűeket, képesek bennük szaporodni, túlélni, belőlük kirajzani és ezáltal elterjedni. Olyannyira alkalmazkodtak a sejten belüli parazita életmódhoz, hogy az egysejtűeken kívüli, a vizes közegben történő osztódásukat még senki sem tudta megfigyelni. Ennek ismeretében feloldható az a látszólagos ellentmondás, hogy ezek a laboratóriumi tenyésztésben nagyon igényes baktériumok a vizes élőhelyeken hogyan képesek igen zord körülményeket is túlélni: az amőbák segítik őket ebben. Kedvezőtlen körülmények közé kerülve az amőbák védőképletet, ún. cisztát képeznek, amely rendkívül ellenálló a fizikai és kémiai behatásokkal szemben. Így ha ezek az eukarióta egysejtűek Legionellákkal fertőzöttek, akkor a baktériumokat is megvédik a káros külső hatásoktól.

1. ábra. Legionella-baktériumok pásztázó elektronmikroszkópos felvétele
A laboratóriumi mérések egyértelműen kimutatták, hogy a Legionellák amőbákból kiszabadított formái sokkal jobban ellenállnak a kémiai fertőtlenítőszereknek és a különböző mérgeknek, mint a Petri-csészében, táptalajon növesztett társaik, tehát már maga a gazdasejten belüli élet is rezisztensebbé teszi őket. Természetes vízi közegükben a Legionellák másik előfordulási helye a különböző felületeket beborító biofilmek, amelyek bonyolult kölcsönhatás-hálózatú mikrobaközösségek. Ezek részeiként szintén komoly védettséget élveznek a környezet kedvezőtlen hatásaival szemben.
A legionáriusbetegség tulajdonképpen az ember saját hasznára történő környezetátalakító tevékenységének a következménye. Ugyanis az ember által különböző célokból hosszabb ideig melegen tartott vizekben a szennyeződésként odakerült Legionelláknak lehetőségük nyílik szaporodni és olyan koncentrációkat elérni, amellyel már fertőzéseket okozhatnak. Előszeretettel telepednek meg hűtőtornyok kondenzvizében, közösségi zuhanyozókban, melegvíz-bojlerekben, párologtató készülékekben, nem kellőképpen tisztított ivóvízrendszerekben, nagyobb épületek (kórházak, irodaházak, szállodák) klímaberendezéseiben. Az 1976-os philadelphiai járvány forrása is a szálloda légkondicionáló berendezése volt. A baktériumok a vízből aeroszol formájában kerülnek a levegőbe, majd belélegezve az emberi szervezetbe. Azt, hogy a legionáriusbetegség fertőző ágensei önmagukban a baktériumok-e, vagy a baktériumokat tartalmazó amőbák, még nem döntötték el egyértelműen, de számos megfigyelés szól az egysejtű gazdák fontos szerepe mellett. A baktériumok már említett tulajdonságain túl (természetes körülmények között csak az amőbákon belül képesek szaporodni; a gazdasejten belüli formáik sokkal ellenállóbbak és fertőzőképesebbek) az amőbák jelentőségére utal az is, hogy a legionáriusbetegség járványos eseteinél a baktériumok mellett az amőbákat is sikerült mindig kimutatni a fertőzési forrásból. Ebben a Legionellák száma általában nagyon alacsony, ezért a nagyobb ellenálló képességű, illetve amőbasejten belüli formáik kompenzálhatják a kis fertőzési dózis hátrányait. Végül szintén nyomós érv az amőbák mellett, hogy még senki sem írta le a baktériumok emberről emberre történő átvitelét; a betegség egyetlen ismert forrásai az ember alkotta berendezésekből származó aeroszolok.
A környezetből patogén baktériumok a bőrön, a tápcsatornán, a húgy-ivar készüléken vagy a légzőszerven keresztül juthatnak be az emberi szervezetbe. A tüdő az egyik legkönnyebb belépési kapu számukra. A Legionellák is a levegőben található, apró, diszpergált vízcseppekben jutnak be a belélegzett levegővel légzőszervünkbe. Természetesen a szervezet nem várja felkészületlenül támadóit. Először a garat- és orrmandulák szűrik meg a belélegzett levegőt. A légcső, a hörgők és hörgőcskék nyálkahártyájában csillós hámsejtek söprik kifelé a letapadt szennyeződéseket. A tüdő léghólyagocskáinak belső felszínén pedig számtalan falósejt, makrofág őrjáratozik. Ezeknek a fehérvérsejteknek az a feladata, hogy a léghólyagocskákig lejutott szennyeződéseket, kórokozókat (így a Legionellákat is) bekebelezzék és lebontsák. A Legionella-baktériumok elleni küzdelemben a celluláris immunrendszer a döntő fontosságú, a humorális immunitásnak csak támogató szerepe van. Takarító funkciójuknak a makrofágok azonban nem mindig tudnak eleget tenni, mert bizonyos baktériumok (köztük a Legionellák is) megakadályozzák, hogy a bekebelezésük után a fehérvérsejt antimikrobiális fegyverei segítségével elpusztítsa őket. A Legionella-baktériumok a makrofágokkal pontosan azt teszik, mint a vizekben az amőbákkal: a sejtet fagocitózisra késztetik, a fagoszómában életben maradnak, sőt szaporodnak, majd a gazdasejt szétesése révén készek újabb prédáik megfertőzésére. A tüdőből így nem tűnnek el, hanem számuk növekszik, és ez akut tüdőgyulladáshoz vezet. A betegség kialakulásának kulcslépése, hogy a Legionellák kijátsszák a makrofágok baktériumölő mechanizmusait, ezáltal egy biztonságos környezetet teremtenek túlélésük és osztódásaik számára.
A fertőzés folyamata
A sejtek fertőzésének első lépése a baktériumok felvétele (fagocitózis), ami 1-2 baktériumsejt bekebelezése. A Legionella-baktériumok vagy a szokványosabb "cipzármodell" szerint, vagy egy ritkább, angol szakkifejezése után magyarra talán "rátekeredő fagocitózisként" fordítható folyamattal kerülhetnek felvételre gazdasejtjeikbe (2. ábra). A legáltalánosabb "cipzármechanizmus" esetén a sejtmembrán két oldalról, sorozatos receptor-ligand kötések létrejötte révén, cipzárszerűen, szorosan ráfűződik a bekebelezendő mikrobára, annak kontúrját követve (3. ábra). A másik esetben azonban először egy, csupán egy oldalról induló sejtmembránnyúlvány öleli át a baktériumot, ami egy irányban haladva többszörösen köré tekeredik, így juttatva őt a gazdasejten belülre. A Legionellák felvételét közvetítő receptorok kiléte amőbák esetén nem ismert, a folyamatban a mikrofilamentumok nem szerepelnek. Az egy-két amőbafajon végzett vizsgálatok kimutatták, hogy a baktérium felvételével egy időben az amőbasejtben a tirozin-foszfatáz-enzimek aktivitása fokozódik, aminek következtében bizonyos membrán- és sejtvázfehérjék alapállapotban foszforilált tirozin-aminosavai elvesztik foszforsavmaradékaikat. Ez a sejtváz szétesését okozza a baktérium felvételének a közelében, és megkönnyíti a baktérium sejtbe jutását. Fehérvérsejteknél fagocitózisuk komplementreceptor- és mikrofilament-függő. Amőbák fertőzésekor leírták a gazdasejt fehérjeszintézisének aktiválódását és több tucat fehérje képződését, míg a fagociták fertőzésekor ez nem tapasztalható. Az immáron bekebelezett baktérium megakadályozza a fagoszóma és a fehérvérsejt bontóenzimeit tartalmazó lizoszómák összeolvadását, meggátolva ezzel elpusztítását. Ez a lépés döntő a mikroorganizmus túlélése és szaporodása szempontjából, ugyanis az erre képtelen mutáns törzsek nem osztódnak a makrofágon belül és nem okoznak fertőzést.
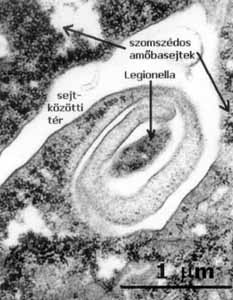
2.
ábra. Egy Legionella-baktérium transzmissziós elektronmikroszkópos
képe. A kórokozó az amőbasejt membránjának többszörös rácsavarodása
révén jut ne a gazdasejtbe
A bekebelezett baktériumot tartalmazó fagoszóma közelében sok mitokondrium és vezikula jelenik meg, majd a fagoszóma a riboszómákat hordozó durva felszínű endoplazmatikus retikulummal fuzionál. A folyamat néhány órát vesz igénybe, ami a gazdasejt említett sejtszervecskéinek részvételével kialakított fagoszóma létrejöttéhez, illetve a baktériumoknak az új környezethez történő alkalmazkodásához szükséges. Ezek után ebben a "fülkében" osztódásnak indulnak a kórokozók. Az endoplazmatikus retikulumnak a fertőzésben betöltött funkcióját még nem értjük, de a baktérium nem saját fehérjéinek szintézisére használja, amire az is utal, hogy egyes, ritkább Legionella-fajok fagoszómái nem fuzionálnak vele. Az elölt Legionellák a hagyományos fagolizoszómába kerülnek, ami az élő baktériumsejt által módosított folyamatra utal. A makrofágba került baktérium alkalmazkodik az új környezetéhez, aminek része számos bakteriális gén átírásának fokozódása, illetve csökkenése. Vannak köztük stressz indukálta fehérjék, illetve a baktérium makromolekuláinak szintézisében részt vevők.
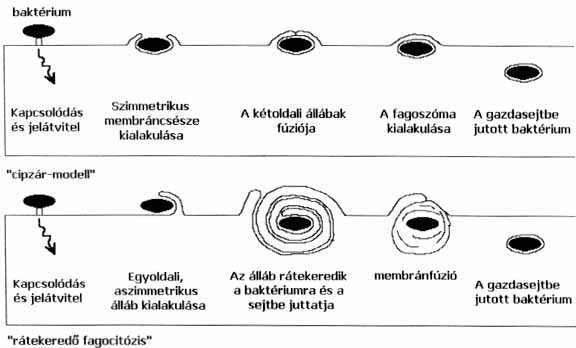
3. ábra. Baktériumok fagocitózisának két lehetséges mechanizmusa
A Legionelláknak jól szabályozott életciklusuk van, amelyet a kutatók két szakaszra különítenek el. Az "osztódási fázisban" (a gazdasejt fertőzésének korai szakaszában) a sejtek hosszúkásak, ostor nélküliek, elegendő tápanyag birtokában aktívan osztódnak. A fagoszómában eleinte csak 1-2 sejtet találunk, az osztódási szakasz végére azonban már az utódsejtek tömege tölti ki a rendelkezésükre álló teret (4. ábra). Az ezt követő "virulens szakaszban" (a gazdasejt megfertőzésének kései fázisában, illetve a gazdasejtből történő kirajzáskor) a tápanyagok csökkent mennyisége miatt a sejtek rövidebbek lesznek, vastagabb sejtfalat építenek, virulenciafaktorokat termelnek, és ostoraik megjelenésével mozgékonnyá válnak. A gazdasejt szétesése révén szabadulnak ki és lesznek képesek újabbakba átjutni. A gazdasejt membránjában pórusok képződését lehet a baktériumok kiszabadulása előtt megfigyelni, így a parazitáik szabályosan kilyuggatják őket, lehetővé téve ezáltal kijutásukat. Ezt a pórusképződést mind az amőbáknál, mind a fehérvérsejteknél kimutatták. A fertőzés kezdetén amőbákban viszont nem, csak a makrofágokban indukálnak a Legionellák apoptozist, így több úton érik el az immunsejtek pusztulását.

4. ábra. Legionella pneumophila baktériumokkal fertőzött amőbasejt transzmissziós elektronmikroszkópos felvétele. A fagoszómában jól láthatók a számos osztódás eredményeképpen keletkezett paraziták
A
fertőzőképesség
molekuláris alapjai
A baktériumok fertőzőképessége szempontjából kulcsfontosságú molekulákat virulenciafaktoroknak nevezzük. Egy több ezer mutáns Legionella-baktériumot felhasználó vizsgálatból kiderült, hogy a kétféle, evolúciósan egymástól távol elhelyezkedő gazdasejt (amőba, makrofág) fertőzésének alapja a folyamatok többségében hasonló. A baktériumok genetikai anyaga azonban kódol néhány olyan virulenciafaktort, amelyek az amőbák infekciójához nem, de a fehérvérsejtekéhez szükségesek, tehát fajspecifikusak. 1989-ben azonosították az első olyan gént, amely a Legionellák virulenciájával kapcsolatba hozható. A mip gén a baktérium egyik felszíni fehérjéjét kódolja, amelyre szüksége van mind az amőbák, mind a fehérvérsejtek megfertőzéséhez. Hatásmechanizmusa azonban egyelőre ismeretlen. A kilencvenes évek második felében egymás után írták le azt a 24 bakteriális gént (angol nevük rövidítése után: icm/dot gének), amelyek a makrofágok Legionellák általi fertőzésében kulcsfontosságúak. Azoknak a mutáns baktériumoknak, amelyekben ezeket a géneket működésképtelenné tették, közös jellemzői, hogy nem képesek a fehérvérsejtet elpusztítani és benne szaporodni, valamint hogy fagoszómáik összeolvadnak a makrofág lizoszómáival. A gének több mint fele a baktériumok belső membránjában elhelyezkedő fehérjéket kódol. Közülük négy nagyon hasonló olyan génekéhez, amelyek a DNS-transzferben szereplő fehérjék információit hordozzák. Egyikük pedig olyan génekkel mutat szerkezeti rokonságot, amelyek baktériumok konjugációjában szereplő, DNS-kötő fehérjéket kódolnak. A bakteriális konjugáció folyamata során két baktérium között sejt-sejt kontaktussal egyirányú génátvitel jön létre egy csőszerű, felületi képződmény segítségével. Kísérleti körülmények között igazolták, hogy a Legionellák képesek DNS átjuttatására más baktériumokba. Úgy tűnik, hogy az említett gének alkotta rendszer fő funkciója valamilyen makromolekulák szekréciója (5. ábra), amelyek eltérítik a fagoszómát normális érési útvonalától. Eléggé valószínűtlen, hogy nukleinsav lenne a transzportált molekula, mert a fagoszóma-lizoszóma fúzió megakadályozása mintegy fél óra alatt megtörténik, ami túl rövid idő ahhoz, hogy a DNS bejusson a makrofágba és róla átíródjanak a végrehajtó fehérjék. Sokkal nagyobb a valószínűsége, hogy fehérjé(k)ről van szó, a szamárköhögést okozó Bordatella pertussis baktérium fő virulenciafaktorához, a kiválasztott pertussis toxinhoz hasonlóan. Az utóbbi két évben - az időközben megismert Legionella-genom vizsgálatai alapján - két fehérjét is azonosítottak, amelyeket az icm/dot rendszer választ ki. Az egyik fehérje valószínű szerepe az, hogy a célsejt membránjában képződő pórus kialakításában vesz részt. A másik fehérje egy olyan kis G-fehérje sejten belüli eloszlását változtatja meg, ami az intracellularis vezikula forgalom szabályozásában tölt be fontos szerepet és ezáltal - feltehetően - a fagoszóma-lizoszóma fúzió meggátlásához járul hozzá.
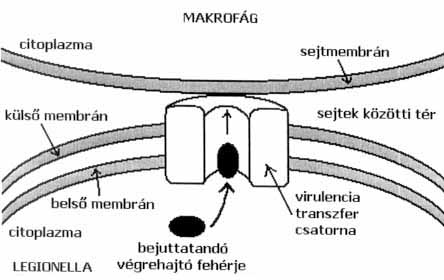
5. ábra. A Legionella-baktériumok transzferrendszerének vázlata. Az icm/dot gének által kódolt fehérjék alkotta csatornán keresztül jutnak be végrehajtyó fehérjék a makrofágba, ahol annak működését megváltoztatják
Számos olyan génlokuszt is találtak, amelyek a baktériumok gazdasejten belüli, intenzív osztódásához létszükségesek. Ismert néhány egyéb virulenciafaktor is (citotoxinok, hősokkfehérjék, foszfolipázok, lipopoliszacharidok, vasforgalomban szereplő fehérjék), amelyek hozzájárulnak a sikeres fertőzőképességhez, nagyrészt azonban még ismeretlen, hogy pontosan hogyan is fejtik ki hatásukat.
A
Legionellák felfedezéséhez egy huszonhét évvel ezelőtti
járvány vezetett. Azóta rengeteg információ gyűlt össze a
baktériumok ökológiájáról, sejtbiológiájáról és az általuk
okozott betegség patomechanizmusáról. Már sokat megértettünk
abból, hogyan képesek a szervezetbe jutott kórokozók elkerülni
végzetüket és milyen eszközökkel változtatják hóhérjaikat
dajkáikká. A kép azonban még messze nem teljes, számos mozaik
hiányzik, seregnyi kérdés vár válaszra. A legionáriusbetegség
hátterében húzódó folyamatok megértésére mindenképpen szükség
van, hogy esélyünk legyen sikeresen fellépni ellene.
Irodalom
Magyar
Pál, Hutás Imre, Vastag Endre: Pulmonológia, 1998, Medicina:
279-282, 293-295.
Grant W. Waterer és munkatársai: Legionella and Community-Acquired
Pneumonia: A Review of Current Diagnostic Tests from a Clinician’s
Viewpoint, The American Journal of Medicine, Vol 110, 2001:
41-48.
Yousef Abu Kwaik és munkatársai: Invasion of Protozoa by Legionella
pneumophila and its role in bacterial ecology and pathogenesis,
Minireview. Applied and Enviromental Microbiology, Sept. 1998,
3127-3133.
Gil Segal and Howard A. Shuman: How is the intracellular fate
of the Legionella pneumophila phagosome determined? Trends
in Microbiology, Vol. 6, No. 7, July 1998.
Drusilla L. Burns: Type IV transporters of pathogenic bacteria.
Current Opinion in Microbiology 2003. Vol 6., 1-6.
| Természet Világa, | 134.
évfolyam, 10. szám, 2003. október http://www.chemonet.hu/TermVil/ http://www.kfki.hu/chemonet/TermVil/ |