Miért dobog a szívünk?
Szívünk dobbanása létünk nélkülözhetetlen feltétele. A szív legnagyobb részét az a szívizomszövet alkotja, amely terheltségünktől, lelkiállapotunktól függően percenként átlagosan 65-ször, egy ember életében csaknem egymilliárdszor húzódik össze. Vajon mi teszi képessé szívünket arra, hogy életünk során fáradhatatlanul végezze munkáját? Miért nem rándul sohasem görcsbe a szívizom? Hogyan képes kielégíteni pillanatnyi szükségleteinket akkor is, amikor alszunk, és akkor is, ha a százméteres síkfutás döntőjében küzdünk a győzelemért? Szívünket azok az ioncsatornák teszik különlegessé, amelyek a szívizomsejtek sejthártyájában vannak. Az írás a szívizom ioncsatornáinak varázslatos világába ad bepillantást. Ha megismerjük az ioncsatornák funkcióját, talán megérthetjük a sérült funkció olyan következményeit, mint a szívritmuszavar vagy a hirtelen szívhalál.
Minden sejtet sejthártya burkol. A sejthártyának két alapvető szerkezeti eleme van. Az egyik az a kettős foszfolipidréteg, ami bár alig 4 nanométer "vastag", kiváló szigetelő, elválasztja a sejt belsejét a külvilágtól. A másikat a fehérjemolekulák olyan típusai alkotják, amelyek jellegzetes kapcsolatot teremtenek a sejt belseje és környezete között. A fehérjék is többfélék. Közéjük tartoznak az ioncsatornák, amelyeken - amikor nyitva vannak - ionok áramlanak át, és az ionpumpák is, amelyek az ATP-ben tárolt energia felhasználásával ionokat pumpálnak át a sejthártya túlsó oldalára (1. ábra).
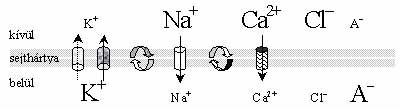
1. ábra. A különféle kationok és anionok eloszlása a sejthártya két oldalán nyugalmi állapotban. Az ábra feltünteti azokat a fontosabb ioncsatorna és ionpumpa típusokat, amelyeknek fontos szerepe van a membránpotenciál kialakulásában és fenntartásában. Az A- jel a fehérjék negatív töltését szimbolizálja. Az ionkoncentráció különbségeket az eltérő betűméret érzékelteti. Az állandó K+ -csatornákat szaggatott, a feszültségszabályozott ioncsatorna féleségeket folytonos nyíl jelöli. A nyilak iránya azt mutatja, hogy milyen irányban áramlanak át az ionok az ioncsatornákon, ha azok nyitottak. A nyilazott jelek egy-egy Na+/K+, illetve Na+/Ca2+-pumpát szimbolizálnak
Az is ismert, hogy a sejthártya két oldala között potenciálkülönbség van (az ún. nyugalmi vagy membránpotenciál), amelynek oka lényegében az, hogy a sejthártya két oldalán eltérő az ionok koncentrációja (1. ábra). A koncentrációkülönbséget az említett pumpák teremtik meg. A potenciálkülönbséget az okozza, hogy a sejthártyában olyan K+-ioncsatornák is vannak, az ún. állandó K+-ioncsatornák, amelyek mindig nyitva vannak, és rajtuk a koncentrációkülönbségnek megfelelően K+-ionok szivárognak ki a sejtből. A távozó K+-ionok negatív töltéseket hagynak maguk mögött (ezek a fehérjék töltései), ami miatt a sejthártya belső felszíne a külsőhöz képest egyre negatívabbá válik. Egy idő után azonban annyira negatív lesz a sejt belseje a külsejéhez képest, hogy az vonzza a pozitív töltésű K+-ionokat, és végeredményben -80 mV érték körül dinamikus egyensúly alakul ki. Az egyensúlyi helyzetre jellemző membránpotenciált nevezik nyugalmi potenciálnak.
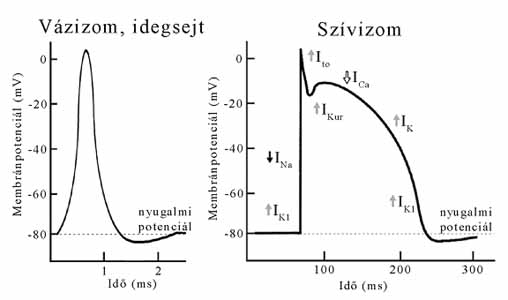
2. ábra. A membránpotenciál-változás időbeli alakulása a sejthártya egy pontján vázizom és idegsejt, valamint egy szívizomsejt esetében. Amíg a vázizom és az idegsejtek esetében a nyugalmi potenciál néhány ezredmásodperc, a szívizomsejtek esetében százszor annyi idő alatt áll helyre. A szívizomra jellemző membránpotenciál-változás bonyolult lefutása a különféle típusú ioncsatornák tevékenységének eredőjeként alakul ki. Amíg a K+ ioncsatornák különféle típusain a sejtből kifelé (fölfelé mutató nyíl) folynak az ionáramok (IK1, Ito, IKur és IK), a Na+ és a Ca2+ ioncsatornákon a sejtekbe (lefelé mutató nyíl) áramlanak az ionok (INa és ICa)
Nyugalmi helyzetben a sejt belseje tehát negatív töltésű a külsejéhez képest. Ha "utasítás" érkezik a sejthez, a membránpotenciál a sejthártya egy adott pontján előbb hirtelen lecsökken, és polaritása a legtöbb esetben át is fordul: a sejthártya belső felszíne lesz pozitív a külsejéhez képest. Aztán rövidesen helyreáll az eredeti állapot (2. ábra). (A membránpotenciál csökken, hisz nulla membránpotenciál-értéknél nincs potenciálkülönbség a sejthártya két oldala között. Bármely, a nullától eltérő pozitív vagy negatív érték esetén mérhető a potenciálkülönbség.) A membránpotenciál-változás alapja az, hogy az "utasítás" hatására előbb nyílnak, majd csukódnaka Na+-, illetve a K+-ioncsatornák. Mialatt az ioncsatornák nyitva vannak, rajtuk Na+- illetve K+-ionok áramlanak át, és minthogy változik az ionok koncentrációja, változik a membránpotenciál is. Az ionok specifikus ioncsatornákon áramlanak át úgy, hogy a csatornák érzékelik a membránpotenciál-változásokat, és annak értékétől függően nyitódnak, majd rövidesen automatikusan csukódnak. Tulajdonságuk alapján feszültségszabályozott ioncsatornáknak is nevezik őket. Fontos tudni, hogy az ioncsatornákon az ionok csak az egyik irányba áramlanak át: a nagyobb koncentrációtól a kisebb felé, diffúzióval. A K+-csatornákon K+-ionok áramlanak ki a sejtből, a Na+-csatornákon pedig Na+-ionok áramlanak be a sejtbe.
Amíg az eredeti állapot az izom, valamint az idegsejtek esetében néhány ezredmásodperc alatt áll helyre, a szívizomsejtek esetében ez 2-3 tizedmásodpercet vesz igénybe (2. ábra). Sőt a szívizomsejtek nemcsak a membránpotenciál-változás időtartamában, hanem a lefutásában is különböznek az izom-, illetve az idegsejtektől. Mi a különbség alapja? A membránpotenciál-változásokat a szívizomsejtekből ki- és az oda beáramló, elsősorban Na+-, K+-és Ca2+-ionok árama okozza a szívizomsejtek funkciója, egy-egy szívdobbanás során. Mi minden történik a szívizomsejtek membránjában egyetlen összehúzódás alatt?
A nyugalomban lévő szívizomsejtek sejthártyájában a feszültségszabályozott K+-és Na+-csatornák zárva vannak. A szomszédos szívizomsejtek, vagy a szív speciális ingerületvezető rendszere felől érkező "utasítás" hatására a Na+-csatornák kinyílnak, és Na+-ionok áramlanak be a sejtbe (INa, 2. ábra), ami következtében a membránpotenciál értéke hirtelen lecsökken, depolarizáció történik. A legtöbb szívizomsejtben vannak ún. átmeneti K+-csatornák, melyek szintén feszültségszabályozottak. A depolarizáció hatására az átmeneti K+-csatornák kinyílnak, és rajtuk keresztül K+-ionok szöknek ki a sejtből (Ito, 2. ábra), és mivel a sejthártya belső oldalán csökken a pozitív töltések száma, a membránpotenciál értéke növekszik, gyors repolarizáció következik be. A gyors átmeneti repolarizációt az ún. platófázis követi. A platófázisban a membránpotenciál értéke hosszú ideig csak lassan növekszik. A tipikusan a szívizomsejtekre jellemző platófázis azonban csak látszólag eseménytelen. Közben nagy mennyiségű Ca2+ áramlik be a sejtbe a feszültségszabályozott Ca2+-csatornákon keresztül (ICa, 2. ábra), és K+-ionok áramlanak ki a sejtből az ún. késleltetett K+-csatornákon át (IK, 2. ábra). A befelé és a kifelé irányuló ionáramok között fennálló egyensúly miatt a membránpotenciál értéke a platófázis folyamán csak kismértékben változik. A platófázis akkor ér véget, amikor bár a Ca2+-csatornák bezáródnak, ám a késleltetett és az állandó K+-csatornákon keresztül további K+-ionok távoznak a sejtből (IK és IK1, 2. ábra). A folyamat nyomán a membránpotenciál értéke folyamatosan növekszik, a sejt repolarizálódik. Sőt a repolarizációt követően a membránpotenciál egy rövid időre meg is haladja a nyugalmi potenciál értékét, amely állapotot hiperpolarizációnak nevezzük. A nyugalmi állapotra jellemző ioneloszlást végül a Na+/Ca2+-, illetve a Na+/K+-pumpák állítják helyre.
A bemutatott folyamat a sejthártya egy adott pontján történő eseményeket írta le. A membránpotenciál-változás azonban nem marad meg a sejthártya egyetlen pontjában. A membránpotenciál-csökkenés nyomán nyílnak a szomszédos feszültségszabályozott ioncsatornák, és végeredményben a membránpotenciál-csökkenés tovaterjed a sejthártya mentén. A sejthártya mentén tovaterjedő membránpotenciál-csökkenést nevezik akciós potenciálnak. A tovaterjedő akciós potenciál az az "utasítás" (ingerület), amely nyomán funkcionálnak az ioncsatornák, összehúzódnak a szívizomsejtjeink, dobog a szívünk.
A szívdobbanás
A vázizom rostjai a mozgatóidegek felől érkező "utasítás" hatására húzódnak össze. A szívizomnak viszont saját ingerképző és ingerületvezető rendszere van. A központ a szinusz csomó, ahol a szív az összehúzódásokhoz szükséges "utasítást" állítja elő (3. ábra). A szinusz csomóban olyan speciális szívizomsejtek vannak, amelyek időről időre akciós potenciált hoznak létre (angolul pacemaker-aktivitásnak nevezik), biztosítva a szívizom ritmusos összehúzódását, a szív dobogását. A szinusz csomótól az akciós potenciál a pitvarokra terjed át, ahol a pitvar izomsejtjeinek összehúzódását okozza. A pitvarizomzat után az akciós potenciál a szív második ingerületképző területére, a pitvar-kamrai csomóra terjed, azt hozza ingerületi állapotba (3. ábra). Itt az ingerület néhány ezredmásodpercet késik. A gondolatnyi késés teszi lehetővé, hogy az összehúzódó pitvarok a még ellazult állapotban lévő kamrákba pumpálhatják a vért. Az ingerület a pitvar-kamrai csomótól a His-kötegeken halad tovább, majd a Tawara-szárakon és a Purkinje-rostokon keresztül jut el a kamrák izomzatáig, ahol a kamrafal izomsejtjeinek összehúzódását okozza.
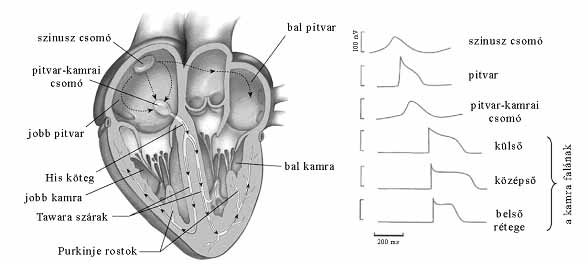
3. ábra. A szív ingerületképző és -vezető rendszere. A nyilak az ingerület terjedési irányát jelzik. Az ábra jobb oldala azt mutatja, hogy milyen az akciós potenciál lefutása a szív különböző régióiban
A dobogó szívben akciós potenciálok, elektromos impulzusok képződnek és terjednek. Az elektromos jelek a szívből kiindulva a test különböző részei felé terjednek, és a testfelszínen elhelyezett elektródákkal meg is mérhetők. Ha a testfelszínen mérhető feszültség változásait az idő függvényében ábrázoljuk, jellegzetes lefutású hullámmintázatot kapunk, az ún. elektrokardiogramot (EKG, 4. ábra).
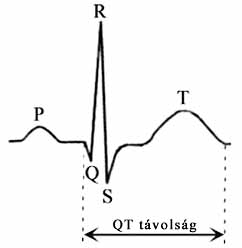
4. ábra. Elektrokardiogram: a szív elektromos aktivitásának időbeli lefutása, amint azt a jobb csuklón és a bal bokán elhelyezett elektródokkal rögzíthetjük. A P hullám a pitvar, a Q, az R és az S csúcsok, valamint a T hullám a kamra izomzatának aktivitását jellemzik. A QT távolság a szívizom ioncsatornáinak állapotát jellemző mérőszám
Az EKG egyes szakaszai a szív különböző területeinek elektromos aktivitásáról nyújtanak információt. A P hullám a pitvarokon végigfutó ingerület eredménye. A nagy amplitúdójú Q, R és S csúcsok által jellemzett motívum pedig a nagyszámú kamrai szívizomsejt közel egy időben történő depolarizációjának a következménye. A T hullám a kamrai izomsejtekben lejátszódó repolarizáció nyomán alakul ki. Az EKG alapján a szívizom állapotáról, a szív ingerületvezető rendszerének állapotáról kaphatunk felvilágosítást. A QT távolság megnyúlása (az ún. hosszú QT szindróma) a repolarizációban részt vevő K+-csatornák csökkent működését jelzi.
A hosszú QT szindróma lehet genetikai vagy szerzett eredetű. A genetikai rendellenességet leggyakrabban olyan mutációk okozzák, amelyek a K+-csatornákat kódoló gének valamelyikében következtek be. A csökkent aktivitású mutáns csatornákon a repolarizáció alatt a normálisnál kevesebb K+-ion áramlik ki a sejtekből, ami miatt a repolarizáció a rendesnél csak hosszabb idő alatt történik meg. Szerzett hosszú QT szindrómát anyagcserezavarok (mint hipokalémia, hipokalcémia, anorexia nervosa), vagy hosszan tartó gyógyszeres kezelés okozhat (elsősorban pszichotróp, antiaritmiás szerek). A hosszú QT szindróma azért veszélyes, mert bár többnyire nem okoz betegséget, tüneteket, növeli a szívritmuszavarok kialakulásának kockázatát, az ún. hirtelen szívhalál bekövetkeztének esélyét. Hirtelen szívhalált okozhat hosszú QT szindrómás emberekben némely gyógyszer is (pl. az antibiotikumok egyike-másika, az antidepresszáns szerek stb.). Azok a hatóanyagok veszélyesek, amelyek gátolják a repolarizációban részt vevő K+-csatornák működését. A repolarizáló ioncsatornák genetikai alapú és gyógyszeres blokkolása nagy valószínűséggel vezet a szívritmus összeomlásához, halálos kimenetelű ritmuszavarhoz.
Különbségek a szív
különféle részei között
Mivel a szív különböző régióinak más és más a feladata, érthető, hogy az akciós potenciál lefutása eltérő a szív különböző területein (3. ábra). Mint azt már említettük, a szinusz- és a pitvar-kamrai csomó sejtjei szabályos időközönként akciós potenciált generálnak. Különleges képességüket szokatlan ioncsatorna-összetételüknek köszönhetik. Bennük speciális "pacemaker", vagyis ritmusképző feszültségszabályozott ioncsatornák vannak. A ritmusképző csatornák különleges tulajdonsága az, hogy nem a depolariáció alatt, hanem a nyugalmi potenciálnál nagyobb értéknél nyílnak. (Ezért hiperpolarizációra aktiválódó csatornáknak is hívjuk őket.) K+-szelektivitásuk gyenge, ami miatt nyitott állapotban a K+-ionok mellett Na+-ionok is átjutnak rajtuk (4 K+- mellett 1 Na+-ion). A szinusz csomó ritmusképző sejtjeinek további jellegzetessége, hogy nincsenek bennük állandó K+-csatornák, melyek kialakíthatnák és fenntarhatnák a nyugalmi potenciált. Hiányukban a ritmusképző sejtekben a nyugalmi potenciál alacsonyabb, mint egy "átlagos" szívizomsejt esetében. Az előzőek miatt a szinusz csomó ritmusképző sejtjeiben az akciós potenciál szokatlanul zajlik le. Az akciós potenciál utolsó szakaszában K+-ionok hagyják el a sejtet, főként a késleltetett K+-csatornákon keresztül. A távozó pozitív töltések miatt a membránpotenciál értéke folyamatosan növekszik, eléri a nyugalmi potenciál értékét, sőt meg is haladja azt, hiperpolarizáció következik be. A hiperpolarizáció hatására kinyílnak a ritmusképző csatornák és rajtuk keresztül a K+- és Na+-ionok - szokatlan módon - a sejtek közötti térből a sejt belseje felé áramlanak. (A hiperpolarizált sejthártya belső felszíne a nyugalmi helyzethez képest sokkal több negatív töltést hordoz, ami miatt a kationok a sejt belseje felé igyekeznek.) A ritmusképző csatornákon befelé csordogáló K+- és Na+-kationok miatt a sejthártya fokozatosan depolarizálódik, amely depolarizáció végeredményben egy újabb akciós potenciál kiváltásához vezet. A pacemakersejtekben a folyamat ismétlődik, belőlük időről időre akciós potenciálok indulnak ki, biztosítva a szív ritmikus funkcióját.
A pitvari szívizomsejtekben mérhető akciós potenciál jellegzetesen rövid lefutású (3. ábra). Itt ugyanis a repolarizáló K+-áramok erőteljesek, és rövid idő alatt képesek helyreállítani a membránpotenciál értékét a nyugalmi szintre a depolarizációt követően. A hatékony repolarizációt a pitvar specifikus ultragyors K+-csatornák biztosítják (IKur, 2. és 3. ábra). Az ultragyors K+-csatornák a késleltetett csatornák olyan változatai, melyek gyorsan reagálnak a membránpotenciál értékének csökkenésére. Társaiknál jóval korábban, közvetlenül a depolarizációt követően nyílnak. Rajtuk K+-ionok áramlanak ki a sejtből, a sejthártyát tehát repolarizálják.
A kamrák falának különböző rétegeiben mért akciós potenciálok bár az általános sémától kevésbé markánsan térnek el, vannak köztük lényeges különbségek (3. ábra). Az akciós potenciál a kamra falának legkülső rétegében játszódik le a legrövidebb idő alatt, a belső rétegben valamivel hosszabb, és a középső rétegben tart a leghosszabb ideig. A külső és a középső rétegre erőteljes platófázis jellemző (az ún. tüske- és kupolakonfiguráció), miközben a belső rétegben a depolarizációt követően a membránpotenciál folyamatosan nő. A jelenség pontos okai nem ismertek, de tudjuk, hogy az átmeneti K+-áram (Ito, 2. ábra) a külső rétegben a legerőteljesebb, a kamra falának belső rétegei felé haladva egyre alacsonyabb intenzitású. A platófázis meredeksége pedig két tényező kölcsönhatásától függ. Nevezetesen a beáramló Ca2+- és a kiáramló K+-ionok mennyiségétől. Ha a sejtbe belépő és a sejtet elhagyó töltések mennyisége megegyezik, a membránpotenciál értéke változatlan marad.
Általánosságban elmondhatjuk, hogy a különböző feladatokat ellátó szívizomsejtekben eltérő az akciós potenciál lefutása. Az akciós potenciál alakja elsősorban attól függ, hogy az adott sejtben milyen ioncsatorna-féleségek és milyen arányban vannak jelen. Egy biztos: a szív olyan tökéletesen "megszerkesztett" része szervezetünknek, amelyben minden a helyén van. A szívdobbanás végső soron a különféle ioncsatornák összehangolt működésének az eredménye. Minthogy az ioncsatornák fehérjék, érthető, hogy szerepüket az őket kódoló gének, illetve a gének expressziós mintázata határozza meg: mely sejtben mely gén terméke van jelen, milyen mennyiségben, és milyen aktívan.
Az akciós potenciál
és a kontrakció
kapcsolata
Az izom-összehúzódás közvetlen oka nem más, mint a Ca2+-ionok kiszabadulása az izom belső Ca2+-raktárából (a szarkoplazmatikus retikulumból, SR) a szívizomsejt citoplazmájába (5. ábra). A Ca2+-felszabadulást az akciós potenciál első és második fázisában, a feszültségszabályozott Ca2+-csatornákon keresztül a citoplazmába áramló Ca2+-ionok okozzák. A jelenséget Ca2+ indukálta Ca2+-felszabadulásnak is nevezik. A szívizomsejteket, amint a harántcsíkoltakat is, át- meg átszövik a sejthártya betüremkedései, az ún. t-csövecskék (5. ábra). Bizonyos helyeken a t-csövecskék és az SR membránja egészen közel fekszenek egymáshoz. Olyannyira, hogy a t-csövecskékben levő feszültségszabályozott Ca2+-csatornák és az SR membránjában levő Ca2+-csatornák (az ún. rianodinreceptorok) egymás közvetlen közelébe kerülnek (5. ábra). A rianodinreceptor lényegében egy olyan Ca2+-ot érzékelő Ca2+-csatorna, amely a Ca2+ hatására nyitott konformációt vesz fel, és lehetővé teszi, hogy az SR-ből Ca2+-ionok áramoljanak a citoplazmába. Amikor tehát kinyílnak a t-csövecskékben levő feszültségszabályozott Ca2+-csatornák, a beáramló Ca2+-ionok a rianodin receptor citoplazmatikus felszínéhez jutnak. Kinyílnak a rianodin receptor-csatornák, az SR-ből Ca2+-ionok áramlanak a citoplazmába, ahol kiváltják az izomfilamentumok összehúzódását.

5. ábra. A különféle típusú ioncsatornák eloszlása a sejthártya, a t-csövecskék,
valamint a szarkoplazmatikus retikulum (SR) membránjában. A citoplazmába
kiáramló Ca2+- ionokat a Ca2+-ionpumpák
(nyilazott "körgyűrűk") szállítják vissza a szarkoplazmatikus retikulumba
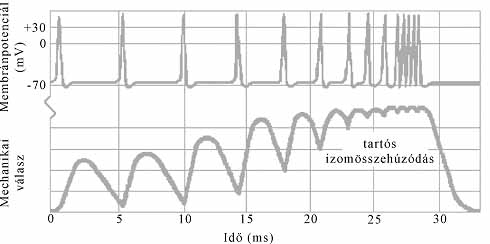
6. ábra. Akciós potenciál és az izomösszehúzódás kapcsolata vázizmokban
A vázizmok esetében az akciós potenciál időtartama sokkal rövidebb, mint az izom összehúzódása és elernyedése (6. ábra). Meg-megtörténik, hogy az izomhoz annak teljes elernyedése előtt újabb akciós potenciál érkezik, ami az izom ismételt összehúzódását váltja ki. Ha az akciós potenciálok elég sűrűn érkeznek, az izom összehúzódva marad. Könnyen belátható, hogy a vérkeringés megszűnéséhez, halálhoz vezetne, ha a szívizomzat folyamatosan összehúzódva maradna. Szerencsére a természet "gondoskodott" arról, hogy a szívizomzat folyamatos összehúzódása ne történhessen meg: a szívizomzatnál az akciós potenciál és az izom összehúzódása majdnem ugyanannyi ideig tart (7. ábra). Újabb akciós potenciál csak akkor indulhat, amikor az izom már elernyedt állapotban van, ami biztosítéka a szívizom ritmusos működésének, a vérkeringés fenntartásának, életünknek.
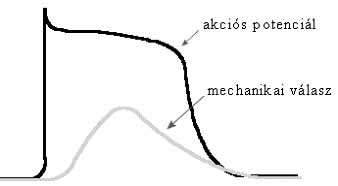
7. ábra. Akciós potenciál és kontrakció szívizomban
Hogyan alkalmazkodik a szív testünk pillanatnyi szükségleteihez?
Szívünk legfontosabb feladata az, hogy a vér keringetésével a testünket alkotó sejtek oxigén- és tápanyagellátását biztosítsa. A test szöveteinek oxigénigényéhez elsősorban a szívritmus idegi szabályozása révén alkalmazkodik szívünk. A szabályozás a két ingerületképző központ, a szinusz csomó és a pitvar-kamrai csomó működésének vegetatív idegrendszeri módosításán keresztül történik. A szimpatikus hatást közvetítő idegvégződésekben noradrenalin szabadul fel, amely úgy befolyásolja a ritmusképző csatornák működését, hogy azok 10 mV-tal alacsonyabb (kevésbé negatív) membránpotenciál-értéknél, vagyis a szokottnál hamarabb nyitnak ki a repolarizációt követően. És minthogy hamarabb nyílnak ki, a ritmusképző sejtekben hamarabb történik meg a depolarizáció (2. ábra), a szívritmus tehát gyorsul, a szaporábban dobogó szív elegendő oxigénnel teli friss vért pumpálhat a test különböző részeibe. A paraszimpatikus hatást a bolygóideg közvetíti. Idegvégződésein acetilkolin szabadul fel. Az acetilkolin egy többlépéses jelátviteli folyamat révén a ritmusképző sejtek eddig nem említett, olyan speciális K+-csatornáit aktiválja, amelyek nyitódása és csukódása egy anyag kötődésétől függ. Az ilyen típusú csatornákat ligandfüggő ioncsatornáknak nevezik. Az itt említett csatornák hiperpolarizáló hatásúak, vagyis növelik a membránpotenciált. A magasabb membránpotenciál-érték miatt a "pacemaker"-csatornák a szokottnál valamivel később nyílnak ki, ami miatt lassul a szívritmus.
Bár a szív igyekszik alkalmazkodni testünk fizikai igénybevételéhez, szükség van egy olyan kontrollmechanizmusra, amely megakadályozza, hogy a fokozott igénybevétel visszafordíthatatlan károsodásokat okozzon a szívizomsejtekben, a szívben. A feladatot a ligandfüggő K+-csatornák egy további speciális változata látja el, amelyet, minthogy "biztosíték"-funkciót lát el, "biztosíték"-csatornának nevezhetnénk. A "biztosíték"-csatornák mindaddig zárva vannak, amíg a szívizomsejtek citoplazmájában az ATP koncentrációja legalább 1 mM. Fokozott terhelés, vagy elégtelen ATP-képződés nyomán előfordulhat, hogy a szívizomsejtek ATP-tartalékai kimerülnek. Ha az ATP-koncentráció 1 mM alá süllyed, a "biztosíték"-csatornák kinyílnak, és hiperpolarizálják a sejthártyát. A hiperpolarizáló hatás miatt lerövidül az akciós potenciál időtartama, és csökken a Ca2+-beáramlás. Összességében tehát csökken a szívizomsejtek terhelése, csökken az ATP-felhasználás, javul a szívizomsejtek túlélési esélye. Sőt az is ismert, hogy egy rövid ideig tartó oxigénhiányos állapot után a szívizom védetté válik egy újabb oxigénhiányos terheléssel szemben: csökken a ritmuszavarok kialakulásának kockázata, az infarktusban elhalt területek aránya. A szív tehát képes valamelyest alkalmazkodni a sorozatos stresszhatások okozta igénybevételhez. Valószínű, hogy az adaptációs folyamat egyik fontos komponensét a "biztosíték"-csatornák adják.
Az ioncsatornák szerkezete
és funkciója
Bár az ionok mozgását az idegsejtek sejthártyáján keresztül már 1952-ben leírták, az ioncsatornák létezésére csak az 1970-es évek óta vannak bizonyítékok. Az ioncsatornák molekuláris szintű tanulmányozása 1984-ben kezdődött, amikor molekulárisan klónozták az elektromos angolna Na+-csatorna génjét. Az első K+-csatorna-gént 1987-ben ismerték meg muslicában. Legnépesebb a K+-ioncsatorna-géncsalád a jelenleg ismert csaknem 80 génnel. Az ioncsatornák szerkezetéről sok mindent kideríthetünk, ha ismerjük a kódoló gének bázissorrendjét. A bázissorrend, a genetikai kód ismeretében meghatározható, hogy milyen aminosavak és milyen sorrendben alkotják a kódolt fehérjét, az aminosavak sorrendje alapján pedig meghatározható a kódolt fehérje legvalószínűbb térbeli szerkezete.
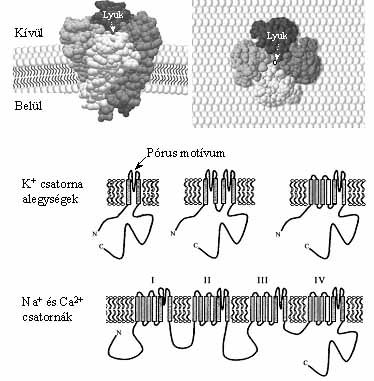
8. ábra. Az ioncsatornák szerkezete. Felül, egy K+-ioncsatorna
háromdimenziós modellje oldal- és felülnézetben. Egy csatorna négy alegységből
szerelődik össze. Középen és lent, a különféle ioncsatorna féleségek alegységeinek
síkban kiterített szerkezete. Amíg a különféle típusú K+-csatornák
két, vagy négy alegységből szerelődnek össze, addig a Na+-
és Ca2+-csatornákat egyetlen hosszú polipeptid lánc alkotja.
A fehéren jelölt transzmembrán a-hélixek a feszültségszabályozott ioncsatornák
feszültség érzékelői, azok az ún. kapuzó hélixek, amelyek szabályozzák a
csatornák nyitódását
A legtöbb K+-csatorna négy alegységből áll (8. ábra). Az egyes alegységek azonos szerkezetűek, még ha különböző gének kódolják is őket. A legegyszerűbb K+-csatorna egy alegységében két a-hélix van, és köztük egy olyan ún. pórusmotívum, amely megszabja, hogy a csatornán milyen ion haladhat át. A "négy alegység" szabálya alól vannak kivételek. Az állandó K+-csatornák bizonyos típusai két alegységből szerelődnek össze, alegységenként négy hélixszel, és két pórusmotívummal. A kódoló DNS-szekvenciák összehasonlítása alapján derült fény arra, hogy a négy hélix az ősi, két hélixet kódoló gén egy részének duplikációja révén keletkezett. A bonyolultabb, feszültségszabályozott K+-csatornák négy alegységből szerelődnek össze. Egy alegység hat a-hélixet és egy pórusmotívumot tartalmaz (8. ábra). A Ca2+- és a Na+-csatornákban a négy alegység egyetlen fehérje része, ugyanannak a génnek a terméke. A feszültségszabályozott ioncsatorna-alegységek alapvető fontosságú részei az a-hélixek, a sejthártyába ágyazottak, és minthogy átérik a sejthártyát, transzmembrán-motívumnak is nevezik őket.
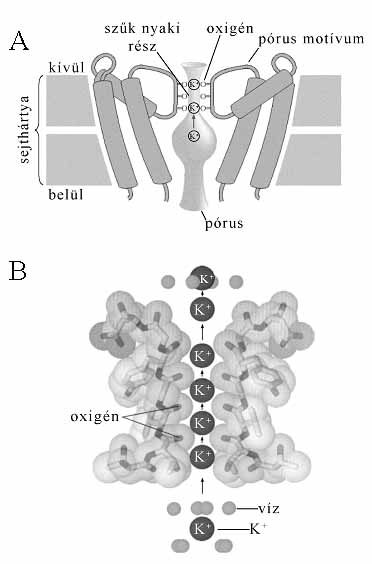
9. ábra. Egy K+ csatorna szerkezete. A: a sejthártyába illeszkedő
csatorna, közepén a szürkén jelölt űrrésszel. B: A csatorna legszűkebb,
nyaki része határozza meg, hogy rajta milyen ion haladhat át
A 9. ábra egy K+-csatorna szerkezetét mutatja vázlatosan. A csatorna funkciója szempontjából legfontosabb a szűk nyaki rész, amely mindössze 1,2 nm hosszú, átmérője pedig 0,28 nm. (Egy nm = 10-9 m.) A csatorna átmérője szabja meg, hogy milyen ionok haladhatnak át rajta. A nyaki rész falát a pórusmotívum aminosavai burkolják. Minthogy a K+-ionok hidrátburkát alkotó vízmolekulák 0,28 nm-re vannak a K+-ion középpontjától, nyilvánvaló, hogy a járat túl szűk egy K+-ion áthaladásához. Ne feledjük azt sem, hogy a hidrátburok vízmolekuláit csak komoly energiabefektetés árán lehet eltávolítani, és a K+-csatornák működésük során nem fogyasztanak energiát. Mégis, miként lehetséges az, hogy a nyitott K+-csatornán másodpercenként nagyjából egymillió K+-ion halad át? És hogyan képes az ioncsatorna különbséget tenni a K+- és Na+-ionok között? A magyarázat az, hogy a szűk járat belső felszínén karbonil- (C=O) oxigén-atomok vannak. Az oxigénatomok részleges negatív töltést hordoznak, és úgy helyezkednek el, hogy a járaton áthaladó K+-ionok a hidrátburok vízmolekulái helyett az oxigénatomokkal lépjenek kölcsönhatásba. A kölcsönhatás energetikailag kedvező környezetet teremt az ionok áthaladásához. A K+-nál kisebb átmérőjű Na+-ionok számára a karboniloxigén-atomok túlságosan távol helyezkednek el, amiért nem tudnak az ionnal kölcsönhatásba lépni, ami miatt a Na+-ionok nem tudnak átjutni a K+-csatornákon. Lényegében tehát az ioncsatorna aminosav-összetétele és az abból következő fizikai szerkezete szabályozza az ionok mozgását a csatornán, a sejtmembránon keresztül.
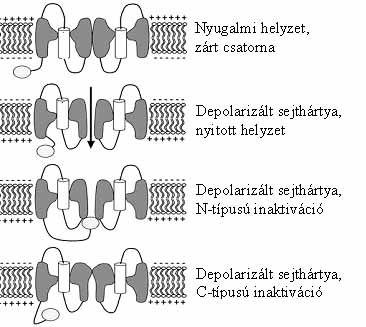
10. ábra. A kapuzó hélix működésének jellegzetes állapotai. Érdemes megfigyelni a fehéren jelölt kapuzó hélix helyzetét a sejthártyában
A feszültségszabályozott ioncsatornák működése a leírtaknál összetettebb: a membránpotenciál pillanatnyi értékének függvényében nyílnak ki vagy záródnak be, és csak akkor láthatják el feladatukat, ha folyamatosan "figyelik" a membránpotenciált, annak változásait. Az ioncsatorna "szeme" a negyedik a-hélix, az ún. feszültségérzékelő, vagy kapuzó hélix. A kapuzó hélixben minden harmadik aminosav pozitívan töltött, arginin vagy lizin (11. ábra). Az argininok és a lizinek meghatározó szerepét az mutatja, hogy minél többüket helyettesítjük más aminosavakkal (pl. alaninnal, glicinnel), annál kevésbé funkcióképesek a csatornák. A kapuzó hélix helyzetét a sejthártyában az határozza meg, hogy milyen kölcsönhatás van a sejthártya két oldalán felhalmozódott töltések és a kapuzó hélixek töltése között (10. ábra). Depolarizáció során a kapuzó hélix a sejthártya külseje felé mozdul, és lényegében miközben megváltozik az ioncsatorna szerkezete, kinyílik, rajta ionok áramlanak át. Az átáramló ionáram erőssége már a depolarizáció alatt csökkenni kezd, mert a csatorna inaktiválódik. A zárt és az inaktivált állapot nem azonos. Sőt a különféle feszültségszabályozott ioncsatornák különböző kinetikával inaktiválódnak. A két legfontosabb inaktivációs mechanizmust N, illetve C típusúnak nevezik. Az N típusú inaktiváció esetében az ioncsatorna fehérje N-terminálisa a pórus citoplazma felőli bejáratához kötődik, bedugaszolja a csatornát (10. ábra). C típusú inaktivációt - nevével ellentétben - nem a fehérje C-terminálisa, hanem a szűk nyaki rész körüli fehérjerészek okozzák: az ioncsatorna a fényképezőgépek blendéjéhez hasonlatos módon záródik. Az idő előrehaladtával a csatorna zárul, és mivel a kapuzó hélix mindaddig a sejthártya külső részében marad, amíg a nyugalmi potenciál nem áll helyre (sőt a valóságban egy kicsit még tovább is), a csatorna egy rövidke ideig nem nyitható. A csatorna csak azután nyitható újra, miután helyreáll a nyugalmi állapotra jellemző membránpotenciál, és a kapuzó hélixek a sejthártya belső felszínére zuhannak. A kapuzó hélix jellegzetes viselkedése biztosítja az ún. refrakter szakasz létét, azt, hogy a csatorna csak valamennyi idő múltán nyitható újra. A csatornák refrakter szakasza pedig azt biztosítja, hogy a depolarizációs hullám a sejthártya mentén csak egy irányba halad, visszafelé sohasem.

11. ábra. A kapuzó hélixeket alkotó aminosavak sorrendje a feszültségszabályozott
ioncsatornákban. A pozitív töltésű arginin (R) és lizin (K) aminosavak szürkén
árnyékoltak
Az ioncsatornák eredete
A különböző fajok csatornagénjeinek nagyfokú hasonlósága közös eredetüket bizonyítja. A legegyszerűbb szerkezetű (állandó) K+-csatornáik már a baktériumoknak is jelen vannak. Velük vannak rokonságban az eukarióták legegyszerűbb K+-csatornái, köztük az állandó K+-csatornák (8. ábra). Bár feszültségszabályozott K+-csatornái vannak minden egysejtű eukarióta élőlénynek, Ca2+-csatornák csak a fejlettebbekben (mint a papucsállatkában) fordulnak elő, Na+-csatornái pedig csak a soksejtű élőlényeknek vannak. A Ca2+- és a Na+-csatornák génjei egy ősi K+-csatorna-gén ismételt duplikációja és módosulása nyomán képződtek. Nyilvánvaló, hogy az ioncsatornák génjei az evolúció során kialakult és bevált funkció megőrződéséről, variálódásáról szólnak.
2006-ban ismerjük az ioncsatornákat
kódoló géneket, és sokat tudunk az ioncsatornák szerkezetéről, működéséről,
ám nem eleget. A K+-csatornák felépülhetnek azonos, de különböző
alegységekből is. Nem tudjuk, hogy miként működnek, és mi a szerepük azoknak
az ioncsatornáknak, amelyek különböző alegységekből szerelődnek össze. Az
ioncsatornákhoz olyan járulékos fehérjék is kapcsolódnak, amelyek módosíthatják
az ioncsatorna kapuzási kinetikáját, és lehetnek ismeretlen funkcióik. Napjaink
kutatásainak két fő vonulata látszik. (i) Kapcsolatteremtése a DNS és az ioncsatornák
funkciója között, hogy meg lehessen előzni a genetikai alapú hirtelen szívhaláleseteket.
(ii) Olyan gyógyszerek tervezése, amelyek segíthetik gyógyítani azokat a betegségeket,
amelyek a szív megváltozott ioncsatorna-funkcióval kapcsolatosak. A két kutatási
irány sikerének az alapja közös: az olyan ioncsatorna-funkciók megismerése,
amelyek az ép szív funkciót biztosítják, lehetővé teszik életünket.
| akciós potenciál: a sejthártya mentén tovaterjedő depolarizációs hullám. állandó K+-csatorna: olyan K+-ioncsatorna féleség, amely mindig nyitva van, rajta K+-ionok szivárognak ki a sejtből. Szerepe alapvető a nyugalmi potenciál kialakulásában. Vannak négy és két alegységből összeszerelődő fajtái is. depolarizáció: folyamat, amely során a nyugalmi potenciál a kb. -80mV (sejttípustól függő) értékről 0 mV felé csökken. elektrokardiogram (EKG): a szív elektromos aktivitás-változást az idő függvényében ábrázoló görbe. Az EKG-t a testfelszín különféle helyein elhelyezett elektródokkal mérik. Feszültségszabályozott ioncsatorna: olyan ioncsatorna-féleségek, amelyek a membránpotenciál-változás során nyílnak, rajtuk - koncentrációkülönbségüknek megfelelő irányban - ionok áramlanak át, majd automatikusan zárulnak. a-hélix: a fehérjék olyan csigavonalban elrendeződött szakaszai, amelyekben három aminosav alkot egy menetet. Az a-hélixeket hidrogénhíd kötések stabilizálják. ioncsatorna: olyan fehérjeféleség, amely a membránba ágyazott (transzmembrán motívumok révén), amelyen nyitott állapotban ionok áramlanak át. ionpumpa: olyan membránba ágyazott fehérje féleség, amely az ATP-ben tárolt energia felhasználásával ionokat juttat a membrán túloldalára. kapuzó hélix: a feszültségszabályozott ioncsatornák olyan alkotója, amely érzékeli a membránpotenciál-változást, és miközben helyzete változik a membránban, nyitja az ioncsatornát. Tehetetlensége az alapja a feszültségszabályozott ioncsatorna ún. refrakter periódusának. membránpotenciál: a sejthártya belső és külső felszíne között nyugalomban mérhető potenciálkülönbség. nyugalmi potenciál: a nyugalomban levő sejt sejthártyájának belső és külső felszíne között mérhető potenciálkülönbség. pacemaker aktivitás: a szinusz csomóban levő olyan sejtek működése, amelyekből szabályos időközökben akciós potenciál generálódik, és terjed át a szomszédos sejtekre. refrakter szakasz: a feszültségszabályozott ioncsatornák működésének olyan rövid szakasza, amely alatt az ioncsatorna nem nyitható ki. repolarizáció: folyamat, amely során (depolarizációt követően) helyreáll a sejtre jellemző nyugalmi- vagy membránpotenciál. rianodin receptor: a szarkoplazmatikus retikulum membránjában levő Ca2+-csatornák, amelyeken aktiválódásuk után Ca2+-ionok áramlanak ki a szarkoplazmatikus retikulumból a citoplazmába. ritmusképző (pacemaker) ioncsatorna: a szinusz csomó ritmusképző sejtjeinek jellegzetes K+ ioncsatornái. A nyugalmi potenciálnál negatívabb értéknél nyílnak, rajtuk a K+-ionok mellett Na+-ionok is átjutnak. szinuszcsomó: a szív jobb pitvarának falában levő, pacemaker aktivitású sejteket tartalmazó, a szív ritmusos összehúzódását adó központ.
|
| Természet Világa, | 137. évfolyam, 3.
szám, 2006. március https://termvil.hu/archiv/ https://chemonet.hu/TermVil/ |
Vissza a tartalomjegyzékhez