Jakabffy Éva
Új hírvivő rendszer
Mindeddig nem sok magyar büszkélkedhet azzal, hogy a Nature Medicine, a talán legrangosabb orvostudományi folyóirat jelentette meg áttekintő tanulmányát egy olyan területről, ahol igen jelentős előrelépés, előretörés következett be. Ilyen írásokat mindössze évi négy-öt alkalommal közölnek csupán az orvostudomány teljes területéről. Idegtudományi témák több évig nem szerepeltek hasábjain, mígnem a lap szerkesztője 2007 novemberében fel nem figyelt a Society for Neuroscience 37 000 résztvevős világkonferenciájának egyik nagyelőadására, amely a kannabinoid jelátviteli rendszerről szólt. Az előadást Bolyai- és Széchenyi-díjas agykutatónk, a Kísérleti Orvostudományi Kutatóintézet igazgatója, Freund Tamás tartotta úgy 10 000 fős hallgatóság előtt. A lapszerkesztő ekkor kérte fel az előadót és a kannabinoid-kutatásban szintén úttörő munkatársát, Katona Istvánt, hogy készítsenek áttekintő tanulmányt a belső kannabinoid rendszerről a folyóirat számára. Ez a felkérés igen nagy elismerés, hiszen hasonlóan a sporthoz, a tudomány számos területén is általában az amerikaiaké a vezető szerep. A magyar szerzőpáros tanulmánya 2008 szeptemberében látott napvilágot a Nature Medicine-ben „A belső kannabinoid jelzés mint szinaptikus biztosíték neurológiai betegségekben” címmel.
A publikáció a KOKI Agykéreg Kutatócsoportjának molekuláris neurobiológiai laboratóriumában 1998 óta folyó tíz éves munka gyümölcse. Éppen egy évtizede kezdtek ugyanis eredeti kutatási témájuk, az agyban lévő gátlósejtek vizsgálata mellett a kannabinoid rendszerrel foglalkozni. A gátlósejtek egyik típusán bukkantak rá az úgynevezett CB1-es receptorokra. Ezek a receptorfehérjék az idegrendszer kannabinoidjait kötik meg, míg a néhány évvel azelőtt felfedezett CB2-es receptorok az immunrendszer sejtjein találhatók. A felfedezést megelőzően több évtizeden át keresték, hol is hatnak agyunkban a kannabisz származékai. Azt már 1964-ben kiderítette a Héber Egyetem kutatója, Raphael Mechoulam, hogy a marihuána és a hasis fő hatóanyaga – a mintegy 60 vegyület közül – a delta-9-tetra-hidro-cannabinol (THC). Ez idézi elő a szorongás oldódását, a fájdalom megszűnését, a tanulási funkciók szünetelését. Vajon mindenképpen külső anyag szükséges ehhez? Nincs agyunkban olyan vegyület, amely „belső boldogságot” idézne elő? De igen, neve „anandamid”, a szanszkrit belső boldogság jelentésű szó alapján. Az idegsejtek által szintetizált kannabinoid felfedezésében 1992-ben, majd 30 évvel a THC elkülönítése után, az amerikai Bill Devane mellett Mechoulam is részt vett.
Amikor Freund Tamás és Katona
István elkezdték kutatásaikat e területen, először a CB1-receptor pontos
elhelyezkedése és az idegrendszerben ellátott feladata érdekelte őket.
A következő kérdésre keresték a választ: milyen sejteken található a receptor
és a sejtek mely részén? Idézzük csak fel, milyen funkcionális részei is
vannak az idegsejtnek! Más idegsejtekről az ingerületek az idegsejtek dendritjeire
érkeznek, melyeknek vannak tüskéi, a tüskéknek feje és nyaka, melyek eltérő
feladatokat látnak el. Az idegrostok végződésében ott találjuk a szinaptikus
hólyagocskákat, amelyekben az ingerületátvivő vegyületek tárolódnak, s
amelyekből felszabadulva a jelet továbbítják. Hol a CB1-receptor? Épp ez
utóbbiak szomszédságában: az idegrost végződésein.
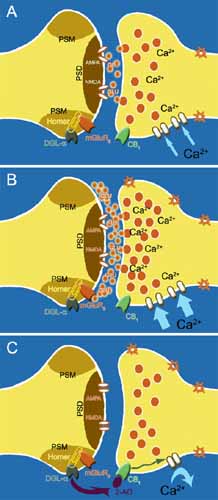 |
A szinaptikus biztosítékmodell.
(A) A központi idegrendszeri serkentő szinapszisokban a legfontosabb ingerületátvivő anyag a glutamát (GLU), amely a fogadó idegsejtek több receptorát is aktiválja a szinapszisok közepén lévő posztszinaptikus megvastagodásban (PSD). (B) Amikor a küldő idegsejt aktivitása fokozódik, a glutamát koncentrációja megnő, így az nagyobb valószínűséggel diffundál ki a szinaptikus rés szélére, ahol a metabotrop glutamátreceptor (főleg mGluR5) várja; ez reakciósorozatot indít be, amelynek egyik végterméke a diacilglicerol (DAG), a 2-AG előanyaga. Az mGluR5 összekapcsolódik a 2-AG-t szintetizáló DGL-a enzimmel, biztosítva, hogy e periszinaptikus molekuláris masinéria (PSM) térben és időben összehangoltan működhessen. (C) A 2-AG a szinapszisban visszafelé haladva kötődik receptorához, a CB1-hez. (A módosított ábrát Urbán Gabriella készítette Baksa Balázs számítógépes grafikus eredeti alkotása alapján.) |
A következő kérdés: mi a feladatuk e receptoroknak, miért részesítette őket előnyben az evolúció, miért olyan elterjedtek az állatvilágban a csalánozók törzsétől kezdve?
Minden receptor feladata
belső ligandjaiknak, azoknak a molekuláknak a megkötése, amelyek a legjobban
tudják őket aktiválni. A későbbi kutatások derítették ki, hogy mi történik
akkor, amikor a CB1-receptor aktiválódik.
Más jelátviteli rendszerekhez
viszonyítva feltűnően késői a kannabinoid rendszer felfedezése. A szerotonint
– a némileg leegyszerűsítő elmélettel együtt, miszerint depresszió egyenlő
szerotoninhiány – ma már szinte mindenki ismeri. A szerotoninszintet növelő
hangulatjavító szereket divat szedni is, szidni is; a két álláspont nem
találkozik, a viták kiélezettek, ami arra utal, hogy e szerek pontos hatás-
(vagy hatástalanság-) mechanizmusa még nem tisztázott. Vajon maga a szerotoninszint-emelkedés
a lényeg, vagy ennek közvetettebb hatásai, mondjuk új idegsejtek keletkezése
az agyban, avagy éppen egy még nem ismert jelenség, például a kannabinoid
rendszer működésének fokozása? Ez sem lehetetlen.
Gyakran hallhatunk és olvashatunk
az endorfin nevű molekuláról, amely elsőként megismert endogén kábítószerünk.
Ez (és más belső opiátok) azok, amelyektől például a meccs kellős közepén
a ficam jóval kevésbé fáj, mint már utána. Az intenzív mozgás, és a felfokozott
hangulat opiátokat szabadít fel az agyban, ezek pedig fájdalomcsillapító
hatásúak. Igen ám, de erre az idegrendszeri bravúrra nemcsak ezek az anyagok
képesek. Épp ilyen hatásúak a belső kannabinoidok is. Azonban a két rendszer,
az opiát és a kannabinoid kapcsolata ennél jóval bonyolultabb. Rejtélyes
módon, a CB1-receptoruktól megfosztott állatok – amelyekben a kannabinoid-receptor
génjét kikapcsolták, röviden CB1 KO egerek – nem szoktathatók rá a morfinra.
Hasonlóképpen az úgynevezett mű-opiát receptor nélküliek sem a THC-re!
A CB1 nélküli állatok minden
téren valóságos aszkéták: sem a nikotin, sem az alkohol, sem a kemény drogok
nem hozzák őket lázba. Az evés terén is mértékletesek. Hasonló irányba
hathat a CB1-receptorok blokkolása is az antagonista szerekkel. Megoldódna
ezzel a szenvedélybetegségek, valamint az ipari országokban az ételek túlkínálatából
eredő tömeges elhízás problémája? Bárcsak ilyen egyszerű lenne a helyzet!
Freund Tamás és Haller József a CB1 KO egereknél a vad típusúakhoz képest jóval erősebb szorongást mutatott ki. Az ilyen állat mind a fizikai veszélytől, mind más állatoktól szorongott, míg a vadaknál ezt az érzést rendre leküzdötte a kíváncsiság. Ráadásul a CB1-hiányos állatoknál sokkal inkább kialakulhatnak epilepsziás rohamok, és a rohamok nyomán tömeges idegsejtelhalások.
Lehet-e a CB1-receptorokat csak éppen annyira blokkolni, amennyire a szenvedélybetegségek és a mértéktelen evés ellen szükséges anélkül, hogy ennek szorongás vagy epilepsziás rohamok kialakulása lenne az ára? Ez ideális lenne. Az első CB1 antagonista szer, a Rimonabant csak nemrégen került forgalomba, és egyelőre csak az EU-ban az elhízás és a dohányzás ellen. Egy tanulmány azt állítja, hogy a szer hatásos a metabolikus szindrómához kapcsolódó szív- és érrendszeri betegségeknél is, az Egyesült Államokban mégis késleltetik a Rimonabant bevezetését, mivel az US Food and Drug Administration a szer súlyos mellékhatásaitól tart. Akiknek valaha is epilepsziás rohamuk volt, azoknál biztosan nem jó választás. Terhes anyáknál való alkalmazása a magzat számára végzetes lehet, és természetesen kontraindikált a szorongóknál, sőt a depresszióra hajlamosaknál is. Kontrakarírozhatja, gyengítheti a szerotoninra ható gyógyszerek hatását. Így egyre kisebb a célcsoport!
Ami miatt leginkább meggondolandó a kannabinoid rendszernek a receptorok útján való megfékezése, az éppen annak fék jellege. A magyar kutatók újabb keletű munkáinak épp ennek bizonyítása az egyik fő eredménye, és egyben a Nature Medicine-ben publikált cikk egyik alapvető mondanivalója. A kannabinoid rendszer, mint fék vagy „biztosíték” ugyanis képes megvédeni agyunkat az egyik legrosszabbtól, ami érheti: az idegsejtek tömeges pusztulásától.
Mikor fenyeget e veszély? Szerencsére nem mindig, és amikor igen, akkor sem mindenütt. Az agyat ért trauma, az agyi infarktus és az epilepsziás roham esetén azonban – minél kiterjedtebbek ezek, annál inkább – tartani kell a tömeges sejtelhalástól. Ilyenkor egy ép belső kannabinoid rendszer működése megmentheti az idegsejtek, sőt akár a páciens életét is. Lássuk, miként teszi ezt, s hogyan jutott az agykutatás e mechanizmus megértésének közelébe.
Az út fordított volt: kezdetben megtalálták a CB1-receptort, s ennek csak később kerültek meg a belső ligandjai. Ezek közül a legfontosabb nem is az elsőként felfedezett anandamid (arachidonoylethanolamid), hanem a 2-AG (2-arachidonoyl-glycerol) volt. Természetesen az anandamid nem csak „ráadásként” van jelen az idegrendszerben; bár pontos feladatának megértése még most is feladat a KOKI és a világ más kutatóinak számára is. A 2-AG keletkezési helye, funkciója azonban már tisztázott. Hét évvel a CB1 elhelyezkedésének pontos meghatározása után, a KOKI kutatói 2006-ban számolhattak be azokról a kísérleteikről, amelyekkel sikerült a 2-AG előanyagának, a DGL-alfa (diacil-glicerol-lipáz-alfa) enzimnek az előfordulását leírniuk.
Az enzimfehérje klónozása egy angol és egy olasz kutatócsoport együttműködéséből született meg. Freund Tamás, Katona István és munkatársaik ezután kezdték vizsgálni az enzim elhelyezkedését. A világ egyik élvonalbeli kannabinoid-szakértője, Vincenzo di Marzo irányította nápolyi kutatócsoport is érdeklődött a további részletek iránt, s elindult azon az úton, amelyen a magyarok. „Ám – meséli Katona István – ebben ők nem szakemberek. Amiben igen, azok a molekuláris biológiai technikák, amelyekkel az enzimet felfedezték. Mi is megkaptuk az immunfestési mintázatot, amely jellegzetesen szemcsés: apró pöttyök láthatók rajta. (Az immunfestés során a keresett molekula és ellenanyaga közti speciális kötődést használják fel. Speciális festési eljárásokkal ez a kapcsolat láthatóvá tehető.) Mi magunk sem gondoltuk, hogy az eredmény ennyire izgalmas lesz, de az már ígéretes volt, hogy többször is nagyon hasonló festést kaptunk. Azt gondoltuk, nem lehet véletlen. Az olaszok azonban úgy vélték, csak szennyeződésről van szó.”
Adott tehát egy mikroszkopikus
felvétel. Ugyanaz a látvány az egyik kutatócsoport számára puszta szennyeződésre
utal, a másiknak viszont egy mintázat, „aminek üzenete van”. „Ám fénymikroszkóppal
ennél tovább nagyon nehéz menni – mondja Katona István. Ilyen esetekben
egy kis darabot kivágunk a metszetből, és speciális gyémántkéssel tovább
szeleteljük. A 60 nanométeres metszeteket pedig már elektronmikroszkóppal
is lehet vizsgálni. Amikor belenéztünk az elektronmikroszkópba, olyan világ
tárult a szemünk elé, amelynek nagyon örülhettünk”. Láthatóvá vált ugyanis,
hogy a keresett enzimfehérje, a DGL-alfa speciális helyen, egészen pontosan
a dendrittüskék feji részén található. Ennek a területnek feladata a más
idegsejtekről érkező ingerületek fogadása. Az elhelyezkedés arra utalt,
hogy a CB1-receptoroknak éppen szemben kell lenniük, amit újabb immunfestéssel
sikerült is igazolni.
Hogyan fest immár a szinapszis
új modellje? A küldő oldalon az idegvégződés hólyagocskái tárolják a klasszikus
hírvivőket. A fogadó oldalon, a szinapszis közepén – az úgynevezett szinapszis
utáni megvastagodásban (PSD) – találhatók e hírvivők receptorai. Vegyünk
egy serkentő, glutamáterg szinapszist. Itt a szinapszis utáni megvastagodásban
ülnek a glutamát gyors receptorai, az AMPA- és az NMDA-receptorok. Amikor
ezekhez glutamát köt be, a fogadó idegsejt hártyáján kinyílik egy ioncsatorna,
ezen ionok száguldanak be, és a sejthártya felszínén mini áramok keletkeznek.
Már jó ideje tudjuk, hogy
az ingerületátvivő anyagoknak vannak más típusú, lassú, úgynevezett metabotropikus
receptorai is. Ezek nem ionok beáramlását teszik lehetővé, hanem anyagcsere-folyamatokat
indítanak el. A glutamát metabotropikus receptorai az mGluR-ok, ezek közül
a kannabinoid jelátvitel szempontjából a legfontosabb az mGluR5. Az Oxfordban
kutató Somogyi Péter mutatta ki, hogy a gyors receptorok mindig a szinapszis
belső részén találhatók, a lassúak viszont a kb. 100 nanométer széles periszinaptikus
gyűrűben, a dendrittüskék felületén. E receptoroknak az lehet a feladata,
hogy a glutamát-koncentráció mérése révén érzékeljék a küldő idegsejt aktivitását.
A serkentő szinapszisok
példáján (bár valójában a gátlók egy részénél is hasonló a mechanizmus),
szemléltetni lehet a kannabinoid jelátvitelt.
Abban az esetben, amikor
a küldő idegsejtből csak mérsékelten ürül glutamát, ez csak a gyors receptorokat
aktiválja. Amikor viszont a küldő idegsejt annyi glutamátot bocsát ki,
amennyi már „kicsorog” a szinapszis szélei felé, az mGluR5 aktiválása is
megtörténik. Mit találunk e receptorok közelében? Katona István és munkatársai
2006-os eredményei szerint éppen azt az enzimet, a DGL-alfát, amely a 2-AG
előállítását katalizálja.
Immunarany-festéssel kimutatták, hogy a DGL-alfa a szinapszis körüli gyűrűben oszlik el, pontosan ott, ahol 1997-ben Somogyi Péter Oxfordban az mGlur 5-öt leírta. A természet – mondhatni – egymás mellé helyezte ezt a receptort és az enzimet.
Mi ezen új információs útvonal
szerepe? Nos, magát a szerepet előbb ismerték, mint a szereplőt. Már a
kilencvenes évek elején több kutatócsoport felfigyelt egy szokatlan jelenségre.
Bradley N. Alger (Marylandi Egyetem), aki a GABAerg gátló sejtek és a hippokampusz
serkentő sejtjei közti szinapszisokat vizsgálta, észrevette, hogy amikor
a serkentő sejtek fokozottan aktívvá válnak, akkor a gátló sejtből történő
GABA-felszabadulás, vagyis a gátló jelzés csökken. Ez azért volt zavarba
ejtő, mert arra utalt, hogy a serkentő sejt – ez esetben a fogadó sejt
– befolyásolta a küldő gátlósejtet. A korábbi dogma szerint ez elképzelhetetlen
volt, úgy vélték, a hírvivők csak a küldőtől a fogadó felé „üzenhetnek”,
viszszajelzés nem lehetséges.
A magyarázatra több évig
kellett várni. 2001-ben Rachel I. Wilson és Roger A. Nicoll (Kaliforniai
Egyetem) publikálták az eredményt, miszerint a rejtélyes anyag egy belső
kannabinoid-molekula lehet. Ezt igazolta, hogy amikor a küldő sejten blokkolták
a CB1-receptorokat, akkor a fogadó sejt nem tudott „visszaszólni” a küldőnek,
ha viszont a receptorokat aktiválták, akkor igen. A szerzők ebből azt a
következtetést vonták le, hogy a belső kannabinoidok visszafelé utaznak
a szinapszisban, aktiválják a CB1-receptort, amely elnyomja más hírvivők
felszabadítását.
2001 után verseny indult, vajon melyik belső kannabinoid lesz a „retrográd” hírvivő. 2004-ben Kim és Alger mutatta ki, hogy biztosan nem az anandamid, hanem valószínűleg a 2-AG. Ezt a feltételezést többen is megerősítették, s a döntő bizonyítékot 2005-ben a Makara Judit és munkatársai (KOKI) által közölt eredmények szolgáltatták.
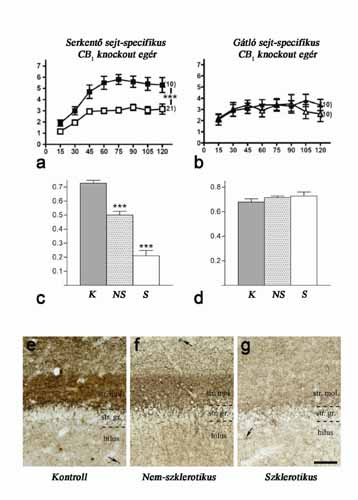
A szinaptikus biztosíték sérülése epilepsziában.
(C) A temporális epilepsziások hippokampuszában kevesebb CB1-receptor található a glutamáterg rostokon, mint a kontroll személyekében (K), különösen a betegség előrehaladottabb szakaszában (S, szklerotikus).
(D) GABAerg-rostoknál ez nem jellemző.
(E-F-G) Fénymikroszkópos felvételek a CB1-et tartalmazó rostok eloszlásáról a gyrus dentatusban. Szklerotikusoknál ilyen rost már alig található. Skála: 100 mm.
(A-B: módosított ábrák Monory Krisztina és Beat Lutz német kutató munkatársainak alapján. C-G: Ludányi Anikó és Katona István ábrái alapján).
Ezzel megoldódott egy korábbi másik kérdés is, hogy miért találhatók agyunkban a kannabinoidok fogadására alkalmas receptorok. Valószínűsíthető, hogy a CB1-receptorok legfőbb feladata a belső kannabinoidok megkötésével a többi ingerületátvivő anyag felszabadulásának szabályozása. Lényegében a küldő idegsejt túlzottan aktív működésekor fellépő negatív visszacsatolásról van tehát szó.
Mennyire általános a kannabinoid jelzés az idegrendszerben? A CB1-et először agykérgi GABAerg gátló idegrost-végződéseken mutatták ki, és úgy gondolták, hogy általában véve gátló sejtek nyúlványán található. A Katona István és munkatársai által 2006-ban publikált adatok azonban bizonyították, hogy a glutamáttal működő serkentő sejteken is ott van a CB1. Azaz a CB1-receptor nemcsak a gátló-serkentő, hanem a serkentő-serkentő szinapszisok működését is szabályozza.
A CB1 az idegrendszer egyik leggyakoribb receptora, melynek nagy száma felér ama receptorok sűrűségével, amelyek a két fő idegi hírvivőt, a serkentő glutamátot és a gátló gamma-amino-vajsavat (GABA) kötik. Szinte az összes szinapszisfajtánál jelen van: az agykérgi, a hippokampális, a hipotalamikus és a kisagyi idegsejtek egyaránt rendelkeznek CB1-receptorokkal, és az újabb eredmények szerint még a kéreg alatti felszálló útvonalak, a kolinerg, noradrenerg, vagy szerotonerg idegrostok is kifejeznek CB1-et. Azaz nem ritkasága, hanem a szinapszisokon belüli szokatlan elhelyezkedése miatt találtak mégis későn rá. Azt is mondhatnánk, hogy ez a receptor – illetve maga a kannabinoid jelátviteli rendszer – nem illett bele az idegrendszeri kommunikáció korábbi paradigmájába.
A belső kannabinoidok kémiai
jellemzői is mások, mint a korábban ismert hírvivőkéi: azokkal ellentétben
ugyanis vízzel nem keveredő (hidrofób) lipidszerű anyagok, amelyeknek nincs
szükségük arra, hogy szinaptikus hólyagocskákban tárolódjanak. Előanyag
formájukban egyszerűen a sejthártyában foglalnak helyet, és csak akkor
szintetizálódnak, ha ez a többi hírvivő túlzott mennyisége miatt szükségessé
válik. Ilymódon a lipidek az agy egy teljesen újszerű belső kommunikációs
rendszerét alkotják.
Általános, az egész idegrendszert
jellemző – bár nem állandó – jelátviteli módról van tehát szó. Ezért nem
is olyan meglepő, hogy olyan különböző funkciókat és reakciókat befolyásol,
mint az étvágy, hangulat, izomtónus, a stresszel, fájdalommal való megküzdés.
De fontos szerepet tölt be olyan magasabb kognitív tevékenységekben is,
mint amilyen a tanulás. A mikrométeres nagyságrendű, gombaszerű dendrittüskék,
amelyekkel kapcsolatban Katona István és munkatársai mutatták ki, hogy
a belső kannabinoidok keletkezési helyei, kulcsszerepet játszanak a tanulási
folyamatokban. A dendrittüskék valószínűleg azért alakultak ki, hogy az
adott idegvégződésből érkező speciális információt a sejt azonnal feldolgozza,
értékelje. A tüskékre érkeznek ugyanis a többi idegsejt felől azok a serkentő
bemenetek, amelyek megerősödése a tanulás, gyengülése a felejtés alapja.
Tanuláskor a szinapszisok hatékonysága megerősödik, vagy két idegsejt közt
több ilyen kapcsolat alakul ki. Felejtéskor épp fordítva: a hatékonyság
gyengül, vagy a kapcsolatok elvesznek. A tüskék száma, mérete és alakja
is megváltozik egy adott memórianyom beíródásakor vagy törlődésekor.
A tanulásnak vannak kóros
formái is: ilyen például a krónikus fájdalom, a nehezen kioltható tanult
félelem és a függőség. A tanult félelemre példa a következő kísérlet. Az
állatok egy hang lejátszását követően enyhe áramütést kapnak a lábukra.
Hamar megtanulják, hogy a hang után előre féljenek az áramütéstől. Ám ha
a hangot többször lejátsszák úgy, hogy nem jár vele áramütés, a félelem
kioltódik. Mi ebben a kannabinoid rendszer szerepe? Úgy tűnik, hogy nem
a társítás, nem a félelem megtanulása, hanem a kioltás. 2003-ban Giovanni
Marsicano (Max Planck Intézet) munkatársaival azt bizonyította, hogy a
CB1 génkiütött egereknél nem szűnik meg a hangtól való tanult félelem.
A belső kannabinoidok tehát alapvető fontosságúak ahhoz, hogy a szorongáskeltő
múltbeli események, mikor már jelentőségük elmúlt, amikor már csak gátolják
a normális életvitelt, megszűnjenek hatni.
A függőségben is lényeges
a tanulás szerepe: az anyag hatására hirtelen jött eufóriát tanulja meg
az agy az adott szerrel, annak beviteli módjával, és a társuló külső körülményekkel
összekötni. Fontos, hogy a váratlanul jött „jutalom” sokkal gyorsabb és
tartósabb tanulást eredményez, mint az elvárt és megérdemelt. Ennek az
lehet az értelme, illetve evolúciós haszna, hogy ha például egy állat adott
helyen váratlanul bőséges táplálékforrást fedez fel, az ide vezető útvonalat
azonnal megjegyezze. Ugyanezen agyi rendszer azonban nem tesz különbséget
váratlan és váratlan között, és ezzel a függőséghez vezető útvonalat is
„kikövezi”. Embernél ez lehet az alapja nemcsak a drog-, alkohol- stb.,
hanem akár a szerencsejáték-függőségnek is: az arra hajlamosaknál elég
egy váratlan nyeremény, hogy a személy újra és újra próbálkozzon, akár
a csődbejutásig is.
Bár mindeddig alapkutatásról volt szó, az idegrendszer mélyszerkezetének ilyen típusú feltárása egy sor eddig rejtélyes neurológiai és pszichiátriai betegség megértéséhez segíthet hozzá: vajon hol és miként támadt zavar az idegsejtek közti kommunikációban például epilepszia, szkizofrénia, szorongásos zavarok vagy szenvedélybetegségek esetén? Ha pedig sikerül a zavar nyomára bukkanni, ebből már adódnak is az új gyógyszercélpontok, s kezdődhet a gyógyszerek fejlesztése. Remélhetőleg olyanoké, amelyek egyre kevésbé a tüneteket, s egyre inkább az okokat képesek kezelni, minél szelektívebben, következésképp minél kevesebb mellékhatással.
Maradjunk a lipidszerű anyagokon belül a kannabinoidoknál. Ezek egyik fő alkalmazási területe lehet az olyan idegrendszeri betegségek kezelése, amelyek a serkentő glutamáterg szinapszisok túlműködésével járnak együtt. Ilyen például a fejsérülés, a sztrók, az agyi infarktus és az epilepszia. Minél kiterjedtebbek, annál nagyobb a veszély. A szinapszis-túlműködés rövid idő alatt idegsejtek tömegének halálát okozhatja. Egy-egy ilyen eseménynél azonban természetes módon is működésbe léphet a belső kannabinoid jelzés. A 2-AG bőség fejsérülés után hirtelen a tízszeresére nőhet, a CB1-receptorok aktivizálása révén nagymértékben csökkentve az agyi ödéma méretét. Kísérleti adatok szerint a CB1-receptorok aktiválása képes csökkenteni az agyi infarktus térfogatát, így az idegsejtveszteség 50 százalékkal kevesebb lesz.
Mindehhez azonban ép kannabinoid jelzésre van szükség; arra, hogy a kannabinoid rendszer összes molekuláris alkotóeleme rendelkezésre álljon, és megfelelően működjék. Vannak azonban olyan állapotok, amelyekben ez nincs így. Ez fordul elő krónikus epilepsziásoknál, ahogy ezt Ludányi Anikónak, a Semmelweis Egyetem doktorandusz hallgatójának a KOKI Agykéreg Kutatócsoportjában Katona István által irányított legújabb kísérletei bizonyították. Egészséges és epilepsziás hippokampusz szövetmintákat összehasonlítva azt találták, hogy a CB1 kifejeződésének szintje az epilepsziás hippokampuszokban drámaian alacsonyabb, az egészségeseknél mért értéknek mindössze egyharmada. A 2-AG szintéziséért felelős DGL-alfa enzim szintjei is csökkentek az epilepsziások egy részénél, azoknál, akiknél a hippokampusz meszesedése is fennállt. Sajnos, maguk a rohamok is kikezdik a kannabinoid jelzéssel működő szinaptikus „biztosítékokat” a serkentő szinapszisokban. A periszinaptikusan elhelyezkedő mGluR5, mely a glutamát-túlcsordulás mértékének nyomonkövetésével szükség esetén beindítja a visszafelé ható jelzőfolyamatot, nagymértékben sérül halmozott rohamok után.
Ahogy a kannabinoid rendszer alkotóelemeinek szintje csökken, úgy alakul ki egyre könnyebben túlműködés a serkentő szinapszisokban. Az epilepsziás agy tehát ördögi körbe kerül: a rohamok nyomán a kannabinoid jelzés alábbhagy, utóbbi miatt a rohamküszöb alacsonyabb lesz, a rohamok száma pedig nő. Hogyan lehet kitörni ebből a körből? Egyelőre csak olyan, nem a kannabinoid jelzésre ható gyógyszerek állnak a betegek rendelkezésére, amelyek bár egy részüknek segítenek, a betegek mintegy harmada esetében nem kontrollálják a rohamokat megfelelő mértékben. És számolni kell a szerek esetleges súlyos mellékhatásaival is: csontlágyulás, csökkent vörösvérsejt-képzés, ínyduzzanat, emocionális zavarok…
Égetően szükség van tehát olyan új szerekre, amelyek az eddig kezelhetetlen epilepsziákat is befolyásolhatnák a jelzett mellékhatások nélkül. Az idegi hírvivő rendszerek „molekuláris logikája” alapján az első felmerülő megoldás lenne az epilepsziások agyában növelni a kívánt anyag, ez esetben a 2-AG jelenlétét. Ez aktiválná a CB1-receptorokat, azok pedig csökkentenék a rohamok valószínűségét. Igen ám, de mint mondtuk, az epilepsziásoknál – legalábbis azoknál, akiknek betegsége súlyos és régóta fennáll – kevesebb a CB1-receptorok száma. S ami még nagyobb baj, elképzelhető, hogy pont a legaktívabb szinapszisokból hiányzik e „biztosíték”, és ezért éppen azokat nem lehet lecsillapítani 2-AG-vel.
A helyzetet súlyosbíthatja,
hogy a 2-AG szint növelése tovább is csökkentheti a CB1-receptorok számát!
Ismert, hogy ha egy sejt receptorait hosszú ideig aktiválják, akkor e sejt
válaszként viszavonja feleslegesnek tartott receptorait. Ez a jelenség
áll amögött is, hogy a kábítószerek egyre kevésbé hatnak, következésképp
egyre több kell belőlük (drogtolerancia). A rendszeres kannabisz-szívás
mindenképpen csökkenti a CB1-receptorok számát, így a rohamküszöböt is.
Ennek oka az, hogy a külső kannabisz az egész agyat elárasztja, mindenütt
befolyásolva az idegvégződéseket. A belső kannabinoidok viszont csak pontosan
időzített és pozícionált fiziológiai ingerek hatására szintetizálódnak.
Mivel zsírban oldódó (lipofil) molekulák, nem is jutnak messzire az agy
vizes, sejten kívüli környezetében, gyorsan lebomlanak, hatásuk korlátozott
idejű. Egy olyan gyógyszer tehát, amely a 2-AG-t lebontó enzimet blokkolná,
feltehetően csupán ezt a helyi hatást nyújtaná meg időben, vagyis ott tartaná
csak hosszabb ideig életben a 2-AG molekulákat, ahol azok keletkeztek,
s ahol így valóban szükség van rájuk. Ily módon igen szelektív hatóanyaghoz
juthatnánk. Azt azonban, hogy mekkora az a dózis, és milyen hosszú az a
kezelési idő, amelynél még nem fenyeget a tolerancia veszélye, nem tudjuk,
ennek meghatározásához rengeteg kísérleti munkára lesz szükség. Csak ezután
lesz reális lehetősége egy ilyen típusú gyógyszer alkalmazásának, s főképp
a betegség korai szakaszában, hogy lassíthassa annak előrehaladását. Próbálkozni
azonban krónikus eseteknél is érdemes: a megmaradt CB1-receptorok talán
jól reagálhatnak a megnövelt 2-AG szintre. Hogyan lehetne megtartani a
CB1-receptorokat az idegvégződéseken? „Engem személy szerint azért érdekel
ez – hangsúlyozza Katona István – mert még inkább a gyökerénél ragadná
meg a problémát”.
| Természet Világa, | 140. évfolyam, 4. szám,
2009. április
https://www.termvil.hu/ https://www.chemonet.hu/TermVil/ |