A kémiai Nobel-díjat 2009-ben
Ada E. Yonath, Thomas A. Steitz és Venkatraman Ramakrishnan vehette át
a riboszómák szerkezetének és működésének tanulmányozásáért. A riboszómák
minden sejtünkben megtalálhatók; szervezetünk fehérjéit „szerelik össze”
a DNS-molekulákban tárolt genetikai információ alapján. Nagy méretük és
heterogenitásuk miatt sokáig úgy tűnt, hogy a riboszómák szerkezetének
felderítése reménytelen vállalkozás. Az utóbbi néhány év azonban látványos
áttörést hozott: nemcsak szerkezetük vált ismertté, hanem a riboszómákhoz
kötődő, új típusú antibiotikumok kifejlesztésére is megnyílt a lehetőség.
 |
 |
 |
| Ada E. Yonath | Venkatraman
Ramakrishnan |
Thomas A. Steitz |
Szervezetünkben folyamatosan keletkeznek új fehérjék. A folyamat a sejtmagban kezdődik, ahol a DNS-ben tárolt genetikai „üzenet” átíródik a hírvivő RNS-molekulára. (messenger RNS; mRNS). Ezt követően az mRNS kilép a sejtmagból és a riboszóma két alegysége közé kapcsolódik, majd a riboszóma az mRNS nukleotidok által kódolt aminosavakból felépíti a fehérjeláncot (1. ábra).
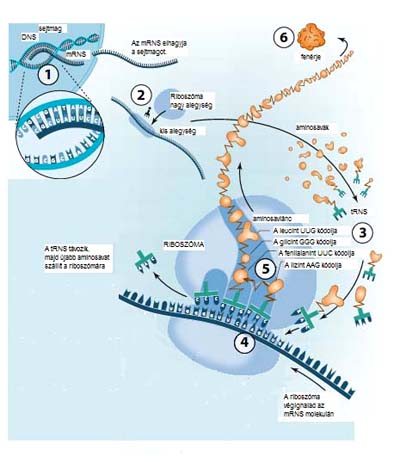
1. ábra. A DNS és a fehérjeszintézis
lépései (a www.nobel.se oldal
nyomán)
A riboszóma tripletenként halad végig az mRNS-molekulán, miközben rákapcsolódnak a megfelelő aminosavakat szállító RNS- (transzfer RNS; tRNS) molekulák. A tRNS-molekulák tartalmazzák azokat a tripleteket (úgynevezett antikodonokat), amelyek az mRNS-molekula megfelelő tripleteihez (kodonjaihoz) képesek kapcsolódni. A tRNS-molekulák másik oldalán egy-egy aminosav található, éppen az, amelyet az mRNS-molekula megfelelő szakasza kódol. Az első felderített kodon az uracil-uracil-uracil (UUU) volt, amely a fenilalanin nevű aminosavat kódolja. Egy aminosavat többféle triplet is kódolhat (a fenilalanint például az UUU és az UUC), ezek általában a harmadik nukleotidban térnek el egymástól. A redundancia nem meglepő, ha végiggondoljuk, hogy a négyféle nukleotidból összesen 43=64-féle kodon keletkezhet, míg a fehérjéket mindössze 20-féle aminosav alkotja. A tripletek közül három úgynevezett stop-kodon a szintézis leállításáért felelős. A riboszómákon másodpercenként 20–30 aminosav kapcsolódik össze, és eközben a hibák száma elenyésző.
A riboszómák két fő részből, egy kis és egy nagy alegységből állnak. Egy bakteriális (70S) riboszóma egy kis (30S) alegységből, és egy nagy (50S) alegységből áll. Az S betű a centrifugáláskor mért ülepedési sebesség mértékének, a Svedberg-egységnek a rövidítése, nem közvetlenül jelzi a méretet, ezért nem additív.
A riboszómák maguk is RNS-molekulákból és fehérjeláncokból állnak, ezt tükrözi a ribonukleinsav és a görög szóma (test) szóból összevont elnevezésük is.
A bakteriális riboszóma kis alegysége 20 különböző fehérjét és egy 1600 nukleotidból álló (16S) RNS-láncot, a nagy alegység 33 különböző fehérjét és két RNS-láncot tartalmaz; egyik 2900 nukleotidból (23S), a másik 120 nukleotidból áll (5S). Az eukarióták riboszómái még ennél is nagyobb és bonyolultabb molekulák, de hasonlóképpen működnek, mint a baktériumok riboszómái.
Többek között a riboszómák hatalmas mérete és heterogenitása magyarázza, hogy nehezen képződnek belőlük kristályok. Pedig a riboszómák szerkezeti részleteibe betekintést engedő röntgendiffrakciós szerkezetmeghatározáshoz jó minőségű kristályokra van szükség. Amikor az 1970-es évek végén Ada Yonath elhatározta, hogy röntgendiffrakciós felvételt készít a riboszómáról, az ötlet a legtöbb ember számára teljességgel lehetetlennek tűnt. Léteznek ugyan ismert szerkezetű, a riboszóma méretét meghaladó vírus-burokfehérjék, de azok kristályosítását elősegíti, hogy nagymértékű szerkezeti szimmetriát mutatnak, ami a riboszómák esetén nem áll fent. Az első, nagy felbontású (2,4 ?) röntgenszerkezetek végül 2000-ben készültek el a riboszómák alegységeiről. A szerkezet felderítéséhez és a működés részletes megértéséhez Thomas Steitz és Venkatraman Ramakrishnan munkái járultak hozzá.
A kristályszerkezetek alapján fény derült arra, hogy a kész riboszómán három kötőhely alakul ki (2. ábra). A lánchosszabbítás során a P helyen épül a peptid, az A helyre érkezik az új aminosav (aminosav-tRNS), és a szintézis végén az E helyen lép ki a szabad tRNS-molekula.

2. ábra. tRNS-molekulák
a riboszóma A, P, és E kötőhelyein
(forrás: https://nobelprize.org/)
Az egyes lépéseket „iniciációs” (láncépítést kezdő) és „elongációs” (láncépítést fenntartó) faktoroknak nevezett fehérjék segítik, a riboszóma pedig folyamatosan továbblépdel az mRNS-molekulán. A fehérjelánc a riboszómában kialakuló hosszú alagúton keresztül távozik, amelynek végén dajkafehérjék védik a formálódó fehérjeláncot az összecsapódás ellen. A stop-kodont elérve a fehérje leválik a riboszómáról, felveszi natív konformációját, a riboszóma két fele pedig szétesik.
A riboszómák központi részén csakis RNS-molekulák találhatók. A katalitikus centrumtól távol helyezkednek el a riboszóma fehérjerészletei. A riboszómát ezért ribozimnak is tekintik, azaz olyan RNS-molekulának, amely kémiai reakciót képes katalizálni – úgy, mint a fehérjék világában az enzimek. A riboszóma egésze nem mutat szimmetriát, a központi rész környékén az A és P kötőhely között mégis található egy szimmetrikus részlet, amelyet Ada Yonath és munkatársa fedezett fel. Itt fordul az A helyen kötődő tRNS-részlet a P kötőhelyre. A riboszóma szerkezetéből adódóan a tRNS-molekula itt csak egyetlen irányba fordulhat, így egyfajta módon érkezhet a P kötőhelybe, ami kulcsszerepet játszik a fehérjelánc szabályos felépítésében. A riboszóma tehát „pozicionális katalízist” tesz lehetővé. A láncépítés lépései szigorú energetikai szabályozás alatt is állnak. Ha az új tRNS-molekula megfelelő antikodont hordoz, az őt szállító elongációs faktoron (Ef-Tu) energiatermelő folyamat megy végbe: egy guanozin-trifoszfát- (GTP) molekula hidrolizálódik, és a tRNS bekötődik az A jelű kötőhelyre. Ha viszont a riboszómára érkező tRNS-molekula nem a megfelelő antikodont hordozza, ez a kötődés nem jön létre.
A riboszóma pontos működéséhez nem elegendő az a magyarázat, hogy a bázispárok a Watson és Crick által felfedezett párosításban erősebb hidrogénhíd-kölcsönhatással kötődnek egymáshoz, mint egyébként. Ramakrishnan és munkatársai felfedezték, hogy a megfelelő párok kötődésekor a kodon-antikodon részlet geometriája is éppen ideális a riboszóma által kialakított kötőhelyen. Ezt a szerkezetet azonban csak az első két nukleotid hozza létre, a harmadiknak elég kevésbé pontosan illeszkednie. Ez a magyarázata annak, hogy a tripletek harmadik nukleotidja változatos lehet, tehát egy tRNS-molekula guaninjával szemben az mRNS-kodon utolsó pozíciójában például nemcsak citozin, hanem uracil is állhat.
A bakteriális és az eukarióta riboszómák közötti eltérések lehetőséget adnak gyógyszerfejlesztésre is. Számos forgalomban levő antibiotikum fejti ki a hatását a bakteriális riboszómákon, és a riboszómákat antibiotikumokkal együtt kristályosítva ezek pontos elhelyezkedését és mechanizmusát is meg lehetett ismerni. A tetraciklin például a 70S riboszóma kis alegységéhez kötődik, ott gátolja az mRNS kötődését, a klóramfenikol megakadályozza, hogy a baktérium új aminosavat építsen a növekvő fehérjére, az eritromicin és a klindamicin pedig a fehérje alagútját zárja el. Ada Yonath Nobel-előadásában kitért arra, hogy két antibiotikum együtt hatékonyabban gátolhatja a bakteriális riboszóma működését, így ezek kombinálásával új típusú antibiotikumokat lehet majd kifejleszteni. (Már ma is találkozunk hasonló módon ható gyógyszerrel: a Synercid nevű, forgalomban levő antibiotikum a riboszóma aktív helyén kötődő dalfopristin és az alagutat elzáró quinupristin kombinációja és ezek együttes, szinergista hatásának köszönhetően igen hatékony. Ada Yonath szerint a kombinált antibiotikumok nagy előnye lehet, hogy ellenük várhatóan lassabban lép majd fel rezisztencia. Thomas Steitz olyan ígéretesnek látja a riboszómákon ható új antibiotikumokban rejlő lehetőségeket, hogy Rib-X néven saját céget is alapított, és egyik ígéretes molekulája már klinikai II. fázison is túljutott.)
A szerkezetmeghatározás
állomásai
Ahogy említettük, a riboszómák
szerkezetének meghatározásához vezető út első lépése, a kristályosítás
nagy kihívást jelentett, Ada Yonathot azonban hajtotta a kíváncsiság. Egy
kerékpárbalesetben szerzett agyrázkódásból lábadozva a jegesmedvék téli
álmáról olvasott, amikor eszébe jutott, hogy ezek a riboszómák csak úgy
vészelhetik át sértetlenül a telet, ha szorosan helyezkednek el. Ha az
amúgy sérülékeny riboszómák képesek ösz-
szezsúfolódni, akkor várhatóan
kristályosíthatók is. Rájött, hogy extrém körülmények között élő baktériumok
riboszómáival kell próbálkoznia, mert azok feltehetően elég stabilak és
keményebb kísérleti körülményeket is elviselnek. Ma már gyakori ez a megközelítés,
akkor viszont meglehetősen új ötletnek számított. Később, amikor arról
kérdezték, miért foglalkozik a riboszómák esélytelennek tűnő kristályosításával,
azt válaszolta: agyrázkódást kaptam. A hőtűrő Geobacillus stearothermophilus
baktériumot választotta, amelyik meleg vizű forrásokban él, a 75 °C-os
hőmérsékletet is elviseli. Jól döntött. 1980-ban sikerült a riboszóma nagy
alegységéről az első háromdimenziós felvételt elkészítenie! A kristályok
azonban még távolról sem voltak tökéletesek. Néhány év múlva a közelben
található Holt-tenger sótűrő baktériumainak riboszómáiból a mérésekre alkalmasabb,
a röntgensugárzást jobban szóró kristályokat növesztett. A technikai lehetőségek
is javultak, elterjedtek a detektálást segítő CCD kamerák és több lehetőség
nyílt a röntgensugárzást előállító szinkrotronok használatára. A megfelelőnek
tűnő kristályok azonban Ada Yonath megdöbbenésére Grenoble-ban, a szinkrotronban
másodpercek alatt elroncsolódtak, nem bírták a felvételt. Úgy érezte, le
kell állnia a munkával. Szerencsére, Hakon Hope segítségével 1986-ban megpróbálkoztak
még egy lehetőséggel, az úgynevezett krio-biokrisztallográfiával, melynek
során a mintát folyékony nitrogén hőmérsékletére hűtik le. Ez a módszer
hozta meg az áttörést, a jól szóró kristályok stabilak maradtak. Innen
kezdve nagyszámú kristályt tudtak előállítani, bár pontos képet mégsem
kaptak a riboszómáról, mert az úgynevezett fázisprobléma megoldása még
megoldásra várt.
A röntgendiffrakciós szerkezetmeghatározás során a fehérjét röntgensugarakkal bombázzák, amelyek az elektronokon szóródnak. A szórási képből matematikai műveletek segítségével azonosítani lehet a fehérje vagy bármely molekula elektroneloszlását. Ahol pedig az elektroneloszlásnak maximuma van, ott találhatók az egyes atomok a molekulában. Ahhoz, hogy a fehérje elektronsűrűséget megkapjuk, szükség van a szórt hullám amplitúdójára és fázisára is. A röntgendiffrakciós kísérletből azonban csak az amplitúdót lehet visszafejteni, a fázist nem, ezt nevezik fázisproblémának. Ennek kiküszöbölésére az egyik módszer, hogy erősen szóró atomokat ültetnek a molekulába és azok segítségével újra elvégzik a kísérletet, ekkor a két szórási kép különbségéből megkaphatók a hiányzó fázisértékek. Steitz erősen szóró, volfrámtartalmú nehézfém-klasztereket épített a molekulába, hogy a szórási jelet erősítse. A nagyméretű riboszóma összes atomjának azonosításához azonban további információra is szükség volt. Végül Joachim Frank elektronmikroszkópos felvételeinek felhasználásával sikerült a riboszóma egyes részleteinek helyét felderíteni és 2000-ben ő közölte a nagy alegység első röntgendiffrakciós szerkezetét. Ramakrishnan és Yonath ugyanabban az évben határozta meg a kis alegység szerkezetét.
Ramakrishnan abban a híres, cambridge-i intézményben dolgozik, ahol Thomas Steitz a posztdoktori éveit töltötte. Az MRC (Medical Research Council) által támogatott LMB (Laboratory of Molecular Biology) számos Nobel-díjas tudóssal büszkélkedhet. Itt dolgozott Francis Crick és James Watson, Max Perutz és John Kendrew, de itt volt PhD-diák a 2009. évi orvosi Nobel-díj egyik nyertese, Elisabeth Blackburn, és itt volt posztdok a 2008. évi kémiai Nobel-díj egyik kitüntetettje, Martin Chalfie. Amikor a Nobel-díj átadása után Ramakrishnant és Steitzet megkérdezték, mi az oka, hogy abból az intézetből annyi Nobel-díjas kutató kerül ki, mindketten a stimuláló közeget említették. „Kritikus szellem uralkodik a munkatársak között – mondta Ramakrishnan. – Nagyon gyakran kérdezik meg az embertől: miért foglalkozol éppen ezzel a témával? Erre nem válaszolhatom azt, hogy a következő cikkemet szeretném publikálni. Egy idő után magamat is meg kell kérdeznem: mennyivel jutok előrébb, ha megtudok valamit?” Steitz posztdok-munkatársként gyakran látta, hogy a kollégák állandóan a büfében ülnek. Mikor dolgoznak? – gondolta magában. Hamarosan kiderült, hogy a szinte kötelező napi többszöri teázás valójában komoly munkamegbeszélést takar. „Számomra ez a kultúra volt a legfontosabb – mondta Steitz. – Megtanultam a tudománnyal foglalkozni, folytonosan kapcsolatban maradni másokkal. Cambridge kiváló környezet a tanuláshoz és a kreatív gondolkodáshoz.”
Ada Yonath sokáig nem talált
támogatókra. Amikor megtudta, hogy Steitz is a riboszómák kutatását tűzte
ki célul, megkönnyebbült: végre valaki, aki nem kételkedik, hanem bízik
a riboszómák kristályosításában. Arra a kérdésre, hogy mi motiválta, azt
válaszolta: a kíváncsiság hajtotta mindvégig. A Nobel-díjak történetében
ő a negyedik női kémiai Nobel-díjas, példaképe gyerekkorában Marie Curie
volt. Ma már ő bízik abban, hogy példája nyomán minél többen választják
a tudományos pályát.
|
Ada Yonath: Egyszerűen tudni akartam, hogyan épül fel a világ A három díjazott közül a leghosszabb kutatói pálya Ada Yonath mögött áll, akit a terület úttörőjeként is számon tartanak. Eredményei láttára a kollégák kétkedését is lassanként felváltotta az elismerés. Nobel-előadását azzal kezdte: „A díj odaítélése óta életemben a legszembetűnőbb változást az a rengeteg virág jelenti, amit az emberektől kapok.” Ada Yonath professzorral február végén, telefonon beszélgettünk. Ezeken a hasábokon részletet olvashatnak az interjúból. – Jó napot kívánok, Simon Ágnes vagyok, Budapestről. Ada Yonath professzorral szeretnék beszélni. – Én vagyok. De hadd csukjam be az ajtót, hogy jobban halljam. – Most is sok virág áll az asztalán? – Ma egy másik ajándékot kaptam, de továbbra is kapok virágokat, igen. – Akkor hadd küldjünk mi is szóban egy csokrot, és gratulálunk Önnek. – Köszönöm. – Professzor asszony, mit tart a legfontosabb eredménynek és a legnagyobb meglepetésnek, amit kutatása során megtudott a riboszómákról? – A legfontosabb eredmény az, amit a működésükről kiderítettünk. Mit tartok a legnagyobb meglepetésnek? Hogy meg tudtam csinálni. Nem viccelek. Azt hiszi, mindig is biztos voltam benne, hogy sikerülni fog? Akkor téved. Ahogy haladt a kutatás, egyre biztosabb lettem a dolgomban, de az egyes állomások között nagyon sok volt a mélypont. – Hogyan vészelte át ezeket a periódusokat? – Úgy éreztem, vannak biztató jelek, amelyek arra utalnak, hogy menni fog, csak éppen nem sikerül mindent jól megcsinálnom, tovább kell próbálkoznom. Mindig úgy éreztem, hogy már rengeteg időm és munkám fekszik benne, annyi mindennel megvagyok, és éppen egy ilyen kis akadály miatt hagyjam abba? A kis akadályról persze néha kiderült, hogy inkább nagy. – Egy korábbi nyilatkozatában úgy fogalmazott, hogy mindig újabb és újabb hegyeket kellett megmásznia. Van általános problémamegoldó stratégiája ezekre a helyzetekre? – Nincs. Nem tervezem el előre, hogy egy adott ponton mit fogok lépni. Annyira bonyolult volt a probléma, hogy nem is sejtettem, milyen állomásai lesznek. Illetve lehet, hogy mégis van egy stratégiám: ki szeretném elégíteni a kíváncsiságomat. Mindig erre törekszem, függetlenül a konkrét problémától, ez fontos része a „stratégiámnak”. – Mit szeretne legközelebb megtudni a riboszómákról? – Sok mindent nem értünk még. Nem értjük teljes egészében a riboszómák működését, sem az antibiotikumokét. Azt is szeretnénk megtudni, hogyan lehet hatékonyabb antibiotikumokat előállítani. – Gyermekkorában, nehéz körülmények között, mi ösztönözte tanulásra? – Egyszerűen tudni szerettem volna, hogyan épül fel a világ. Nem a tanulás járt az eszemben, csak az a csodaszép világ, amit nem ismerek, ami a szegénység miatt nem része az életemnek. Meg akartam tudni, hogyan jönnek létre a dolgok és hogyan működnek. – Marie Curie példája hogyan inspirálta? – Nagyon tetszett, hogy szerette volna megérteni maga körül a dolgokat. – 2011-ben az ő kémiai Nobel-díjának 100. évfordulója tiszteletére ünnepeljük a Kémia Nemzetközi Évét. Vannak feladatai ebből az alkalomból? – Igen, három-négy konferenciára is megyek. – Amikor megkapta az Izrael-díjat, unokája meghívta az óvodába is, hogy tartson előadást. Elmesélné, mit mondott akkor az óvodásoknak? – A baktériumokról beszéltem, és arról, hogyan lehet védekezni ellenük. Meg kell előzni például, hogy a baktériumok tönkretegyék a gyerekek fogát. Különböző korú gyerekek voltak ott, kisebbek, nagyobbak, tetszett nekik. Szeretik, ha úgy beszélek valamiről, hogy kicsit ők is értsék. S. Á. |
| Természet Világa, | 141. évfolyam, 4. szám,
2010. április
https://www.termvil.hu/ https://www.chemonet.hu/TermVil/ |