Honti Viktor
Génszabályozás a vérsejtképzés során
Szervezetünk minden egyes sejtje ugyanazt a genetikai információt hordozza, ám ezt a különböző sejtek más és más módon használják fel. Hogy sejtjeink mind alakjukban, mind működésükben különbözzenek egymástól, fejlődési programjuknak megfelelően időben és térben ki kell alakítaniuk a rájuk jellemző génkifejeződési mintázatot. Ennek megfelelően a sejtek érésük során a rendelkezésükre álló azonos készletből különböző géneket kapcsolnak be és fejeznek ki (expresszálnak), illetve kapcsolnak ki (represszálnak). Ez a mintázat az érés során fokozatosan, lépésről lépésre alakul ki.
Ez történik vérsejtjeink képződése során is. A vérsejtképző őssejtek (hematopoietikus őssejtek) képesek bármilyen vérsejtet létrehozni, de a keletkezett vérsejtek csak akkor látják el feladatukat, ha hibátlanul hozzák létre a rájuk jellemző génkifejeződési mintázatot. Így, amikor a vérsejtek közül az ellenanyagokat termelő B-limfociták (B-sejtek) differenciálódni kezdenek, aktiválják a B-sejt receptorának felépítéséhez és működéséhez szükséges géneket, míg a testidegen részecskéket bekebelező makrofágok érésük során olyan géneket kapcsolnak be, amelyek a baktériumok bekebelezéséhez (fagocitózisához) szükséges receptorokat kódolják. Ugyanakkor a B-sejtek elköteleződésükkel egy időben kikapcsolják a fagocitózis génjeit, hiszen ezekre működésük során nem lesz szükségük.
A szabályozás első szintje
A gének átírásának
közvetlen szabályozása
Az egyes sejttípusokra jellemző
génkifejeződési mintázatot a gének átírása, a transzkripció szabályozása
révén alakítja ki a sejt. Mit jelent a transzkripciós szabályozás a molekulák
szintjén? Nem mást, mint a transzkripciós gépezet (RNS-polimerázkomplex)
működésének szabályozását. A szabályozáshoz szükség van úgynevezett cisz-elemekre
és transz-faktorokra. A cisz-elemek olyan DNS-szakaszok, melyekhez a transz-faktorok
(a transzkripciós faktorok) kötődnek, ezáltal segítve elő az adott gén
átírását. A gének sejttípusra jellemző kifejeződési mintázatát az biztosítja,
hogy az egyes transz-faktorok csak a nekik megfelelő cisz-elemekhez képesek
kötődni, másokhoz nem.
Ahhoz, hogy az egyes sejttípusokra
jellemző génkifejeződési mintázat létrejöhessen, a célgéneket szabályozó
transzkripciós faktoroknak is az egyes sejtekre jellemző specifikus mintázat
szerint kell kifejeződniük. Elmondható tehát, hogy minden sejthez hozzárendelhető
egy összetett transzkripciós faktor aktivitási mintázat, amelynek a megléte
alapvető fontosságú az adott sejttípus érése és működése szempontjából.
Hogyan történik a vérsejtek
keletkezésének és érésének transzkripciós szabályozása? Ahhoz, hogy erre
az általános kérdésre választ kapjunk, vizsgáljuk meg két egymástól evolúciósan
távol álló állatfaj, az ecetmuslica (mint a rovarok képviselője), illetve
az egér (emlősmodell) vérsejtjeinek éréséhez szükséges génszabályozási
folyamatokat. De mielőtt ezt megtennénk, tekintsük át, hogy mi a különbség,
illetve a hasonlóság a két állatcsoport vérsejtjeinek keletkezése, illetve
immunrendszerének működése között.
Vérsejtek az emlősökben
és az ecetmuslicában
Az ecetmuslica immunrendszere
látszólag nem nagyon hasonlít az emlősökére. Míg az emlősöknek van mind
veleszületett, mind szerzett immunitása, az ecetmuslicát kizárólag igen
hatékony veleszületett immunrendszere védi a fertőzésekkel, betolakodókkal
szemben. Az immunrendszer sejtjei is eltérő útvonalakon „őrjáratoznak”
bennük; az ecetmuslicának (mint minden rovarnak) nyitott keringése van,
tehát nincsenek külön vér-, illetve nyirokerei. Arról sem szabad megfeledkezni,
hogy az ecetmuslica teljes átalakulással – lárva- és bábállapoton keresztül
– fejlődő állat, ami alapvetően más egyedfejlődési mintát jelent, mint
az emlősök közvetlen fejlődése. Ha azonban a vérsejtek keletkezésének,
érésének és működésének alapvető jellegzetességeit vizsgáljuk, akkor meglepő
hasonlóságokat találunk a két rendszer között (Hartenstein, 2006, 1. ábra).
Az emlősök vérsejtjei nagyon
sokfélék, és számtalan különféle feladat ellátására specializálódtak. Ennek
a sokféleségnek a tükrében talán meglepő, hogy ezen sejtek mindegyike egyféle
őssejtre, az úgynevezett hematopoietikus (vérképző) őssejtre eredeztethető
vissza. Az emlősök vérsejtjei két hullámban keletkeznek, amelyeket primitív
és definitív vérképzésnek nevezünk. A primitív vérképzés embriókorban zajlik;
ekkor az embrión kívüli területen – a szikzacskóban – keletkeznek az első
vérsejtek. A második hullámban – a definitív vérsejtképzés során – egyes
embrionális szövetek (az aorta, az embrionális vese és az ivarszervek területe)
is részt vesznek a vérsejtek képzésében. Az itt keletkező sejtek vándorlásuk
során a magzati májba, illetve a csontvelőbe jutnak. A csontvelőben letelepedő
sejtek „őssejtniche”-eket (fülkéket, kamrákat) alakítanak ki, ahol a hematopoietikus
őssejtek osztódással biztosítják vérsejtjeink megújulását. Az itt keletkező
sejtek különféle fejlődési utakat járnak be, melynek során az egyes feladatokra
specializált érett vérsejtalakok alakulnak ki belőlük (Martinez-Agosto
és mtsai, 2007).
Az emlősökben alapvetően
két vérsejt-leszármazási vonal különíthető el: a mieloid és a limfoid típusú
sejtek vonala. A mieloid vonalhoz tartoznak a vörösvértestek, a vérlemezkéket
termelő megakariociták, a bekebelezést végző makrofágok és a különböző
típusú és szerteágazó feladatokat ellátó granulociták. A limfoid vonal
legfőbb képviselői a szerzett immunválasz sejtes elemei, a B- és T-sejtek.
Ezen sejtek érésében a másodlagos nyirokszervek (valamint a nyirokcsomók)
is fontos szerepet töltenek be. Mivel az emlősök vörösvértestjei az oxigén
szállítását végzik, és hasonló sejtek a rovarokban nincsenek, írásom az
immunsejtek érésének szabályozására szorítkozik.
Az emlősök vérsejtjeihez
hasonlóan, az ecetmuslica vérsejtjei, a hemociták már a korai embrióban
elköteleződnek. Két, egymástól elkülönült mezodermasáv (a mezoderma a középső
csíralemez) vesz részt a vérsejtek képzésében. A feji mezodermasávban makrofágok
és kristálysejtek képződnek. A makrofágok fagocitózisra (bekebelezésre)
képes sejtek, melyek fontos szerephez jutnak az embrió fejlődése során.
Ezek a vérsejtek bejárják az egész embriót, eltakarítják az elpusztult
sejteket és kialakítják az idegsejtek nyúlványainak fejlődéséhez szükséges
csatornákat. A kristálysejtek nem vándorolnak, a teljes embrionális fejlődés
ideje alatt keletkezésük helyén maradnak. A másik mezodermasáv, amely részt
vesz a vérsejtek képzésében, az úgynevezett laterális (oldalsó), vagy kardiogén
mezoderma. Az itt keletkezett vérsejtek alkotják később a lárva központi
nyirokszervét (Evans és mtsai, 2003).
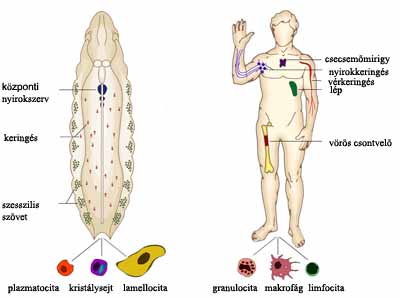
1. ábra. Az ecetmuslica
és az ember immunrendszerének összehasonlítása.
Az ábrán a főbb immunszervek,
vérsejt-kompartmentumok, illetve vérsejttípusok láthatók
Az ecetmuslica lárvájának hatékony immunvédelmi rendszere van a betolakodókkal szemben. A lárvában a vérsejtek három egységben, úgynevezett kompartmentumban helyezkednek el (1. ábra). Ezek egyike a már korábban említett központi nyirokszerv. A központi nyirokszerv a szívcső két oldalán található páros, lebenyes szerv. A belsejében (velőállomány, medulla) éretlen vérsejtek (prohemociták), a kérgi részében (cortex) pedig érett vérsejtek helyezkednek el. Egy kitüntetett régió (a poszterior szignalizációs központ) sejtjei felelősek a központi nyirokszerv sejtjeinek érési folyamataiért. A központi nyirokszerv felépítése sok szempontból hasonlít az emlősök „őssejtniche”-eire, például a csontvelőre, ahol az éretlen sejtek egy elkülönített kamrában helyezkednek el, az érett vérsejtek pedig a kamrán („niche”-en) kívül foglalnak helyet. Jelenlegi ismereteink szerint a központi nyirokszerv sejtjei csak a bábozódás előtt, illetve az immunválasz során hagyják el a nyirokszervet.
A másik kompartmentum, ahol vérsejtek helyezkednek el és keletkeznek, a szesszilis szövet. A szesszilis szövetet a lárva belső testfalára kitapadt vérsejtek alkotják. Immunológiai módszerekkel kimutatható, hogy ezen sejtek egy része vérképző őssejt. A szesszilis szövet kitüntetett területe a poszterior vérképző szövet, ami esetleg a központi nyirokszervhez hasonlóan vérsejtképző „niche”-ként viselkedhet (Márkus és mtsai, 2009).
A harmadik kompartmentumot a lárva testfolyadékában (hemolimfa) keringő vérsejtek alkotják. A lárva keringésében háromféle vérsejt különböztethető meg: a plazmatociták, a kristálysejtek és a lamellociták. A plazmatociták kis gömb alakú sejtek, melyek képesek baktériumokat fagocitálni, illetve antimikrobiális (baktérium és gomba ellenes) peptideket termelnek. Más kis kerek sejtek – a kristálysejtek – speciális enzimeket tartalmaznak kristályok formájában; ezek a sejtek fontos szerepet töltenek be a véralvadás folyamatában is. A harmadik sejttípus – a nagy, lapos lamellocita – csak immunindukció hatására jelenik meg a keringésben (2. ábra).

2. ábra. (A) Vérsejtek
(hemociták) az ecetmuslicában. A kis kerek sejtek a plazmatociták, amelyeket
a bekebelezett baktériumok vörös színnel
jelölnek meg. A zöld
immunfluoreszcenciával jelölt nagy lapos sejtek a lamellociták. A sejtmagok
kék jelöléssel (DAPI) láthatók. (B) Az ecetmuslica kifinomult genetikai
rendszerének köszönhetően élő állatokban is megfigyelhetjük a vérsejteket.
Az ábrán egy lárva látható, a nyilak lamellocitákra mutatnak (Honti és
mtsai, 2009)
Ilyen immunindukció lehet például az, amikor egy parazitoid darázs a petéjét az ecetmuslica lárvájába helyezi. Hogy a fejlődő darázs ne pusztíthassa el a lárvát, az ecetmuslicának azt hatástalanítania kell. Ebben játszanak fontos szerepet a lamellociták, mégpedig úgy, hogy a plazmatociták segítségével több rétegű tokot képeznek a pete körül, majd megölik azt. Ez a tokképzési folyamat meglepő hasonlóságot mutat az emlősök granuloma-képzéséhez (tályogképzés), melynek során különféle vérsejtek, például sokmagvú óriássejtek tokot képezve elszigetelik azokat a szövetrészeket vagy idegen testeket, amelyeket az immunrendszer nem képes eltávolítani.
Honnan származnak a lamellociták? Miután a darázs megfertőzi a lárvát, mind a szesszilis szövet, mind a központi nyirokszerv szerkezete felbomlik, és sejtjeik a keringésbe kerülnek. Ezeknek a vérsejteknek egy része lamellocitává alakul, és részt vesz a darázslárva körüli tok kialakításában (Márkus és mtsai, 2009; Honti és mtsai, 2010).
Könnyen észrevehető tehát, hogy a látszólagos különbségek ellenére az ecetmuslica és az emlősök immunrendszere valójában sok jellegzetességében hasonlít egymásra. Hasonló a vérsejtek több hullámban történő keletkezése, és az őssejtek „niche”-ekben való elhelyezkedése. Hasonlóak a vérsejtek alapvető feladatai is: a baktériumok bekebelezése, a tokképzés és a véralvadás szabályozása.
Ha figyelembe vesszük e hasonlóságokat, talán nem annyira meglepő, hogy a gerincesek és az ecetmuslica vérképzésének és a vérsejtek érésének transzkripciós szabályozása is sok hasonlóságot mutat egymással (Evans és Banerjee, 2003). Azok a transzkripciós faktorok, amelyek az egyes vérsejttípusok sejtsorsának kijelöléséhez szükségesek, megőrződtek az evolúció során. Ezek közé a faktorok közé tartozik a GATA-fehérje, mely emlősökben számos vérsejttípus éréséhez szükséges. Ennek megfelelője ecetmuslicában a Serpent-fehérje, amely a vérsejtsors egyik legfőbb szabályozó faktora. Hasonlóan megőrződött a FOG- (ecetmuslica megfelelője az U-shaped fehérje) és az AML- (ecetmuslica megfelelője a Lozenge) fehérjék funkciója is, melyek mind ecetmuslicában, mind emlősökben alapvető szabályozó szerepet játszanak a különféle vérsejttípusok differenciálódása során. Bár a limfoid vérsejtvonal nincs jelen az ecetmuslicában, érdekes módon a B-sejtek elköteleződéséért felelős fehérje, az EBF (Early B cell Factor) megfelelője – a Collier fehérje – itt is megtalálható, és nélkülözhetetlen a lamellociták éréséhez. Nemcsak a vérsejtek érését befolyásoló faktorok konzerváltak, hanem a vérsejtek vándorlását irányító jelátviteli utak is nagyon hasonlítanak egymásra emlősökben és rovarokban (3. ábra).

3. ábra. Vérsejtleszármazási vonalak emlősökben (A) és ecetmuslicában (B). A vérsejtek sorsát befolyásoló transzkripciós faktorok megőrződtek az evolúció során. Az egymásnak megfelelő transzkripciós faktorokat azonos szín jelöli
A szabályozás második
szintje
Az aktív és az inaktív
kromatin
Az eddig leírtak alapján
úgy tűnhet, hogy ha egy sejtben egy adott transzkripciós faktor kombináció
jelen van, akkor az – a megfelelő célgének szabályozásán keresztül – megmásíthatatlanul
megszabja az adott sejt sorsát. Ez azonban nem ilyen egyszerű, hiszen korántsem
biztos, hogy egy transzkripciós faktor képes hozzáférni azokhoz a DNS-szakaszokhoz,
amelyeken keresztül a hatását ki tudja fejteni. A sejtmagvakban ugyanis
a DNS nem szabadon, hanem egy DNS-fehérje komplexbe szerveződve, az úgynevezett
kromatin formájában van jelen.
A kromatin építőkövei a nukleoszómák, amelyek bázikus fehérjékből (hisztonokból) és DNS-ből épülnek fel. A nukleoszóma magi része egy fehérje oktamer (nyolc fehérjét tartalmazó komplex), amely négyféle hisztonfehérjét (H2A, H2B, H3 és H4) tartalmaz. A nukleoszóma-magvakból és a köréjük csavarodó DNS-fonálból álló „gyöngyfüzér-szerkezet” több lépésben tovább tömöríthető. Ebben a tömörítésben részt vesz egy ötödik hisztonfehérje (a H1) is, mely az egyes nukleoszómák között létesít kapcsolatot. A kromatin még számos más fehérjét is tartalmaz, amelyek tömörítik és strukturálják a szerkezetét. Számos kromatinfehérje közreműködésével, több lépésben, a kromatin a kiindulási „gyöngyfüzérnél” sokkal tömörebb szerkezetét képes felvenni. A kromatin nem csupán strukturálja örökítő anyagunkat, hanem a gének szabályozásában is fontos szerepet játszik: a „nyitott” kromatinszerkezetű (eukromatikus) gének átíródhatnak, a „zárt” kromatinszerkezet (heterokromatin) viszont nem teszi lehetővé a gének kifejeződését (4. ábra).

4. ábra. (A) A kromatin
építőkövei a nukleoszómák, melyek DNS-ből és
hisztonfehérjékből állnak.
A tömör kromatin felépülése több lépéses folyamat, mely számos fehérjét
igényel. (B) A gének átírását a kromatin szerkezete is befolyásolja. Az
ábrán a kromatin szerkezetét érintő lehetséges módosítások láthatók
Nagyon nehéz pontosan meghatározni, hogy mit is jelent a „nyitott” és a „zárt” kromatinszerkezet. Annyi bizonyos, hogy a „zárt” kromatin nehezebben hozzáférhető bizonyos fehérjefaktorok számára. A heterokromatin tulajdonképpen molekuláris szűrőként viselkedik, amely a nagyobb fehérjéket, fehérjekomplexeket, például a transzkripcióhoz elengedhetetlen RNS-polimerázt nem engedi a DNS közelébe férkőzni. A „nyitott” kromatin ezzel szemben laza szerkezetű, és kevesebb nukleoszómát tartalmaz. A „nyitott” szerkezetű (aktív) és „zárt” szerkezetű (inaktív) kromatin a sejtmagon belül elkülönülve, nukleáris doménekben (a sejtmag egymástól elkülöníthető területei) foglal helyet.
A magasabb rendű kromatinszerkezet
szabályozásán, az aktív és inaktív kromatin kialakításán keresztül megvalósuló
génszabályozási formát epigenetikus szabályozásnak nevezzük. Az ilyenfajta
szabályozás nem közvetlenül az RNS átírásra, a transzkripciós masinériára
(gépezetre) hat, hanem a kromatin szerkezetének befolyásolásán keresztül
megengedi, vagy meggátolja a gének átírását.
Mivel az ecetmuslicát évtizedek
óta használják a kromatinszerkezet tanulmányozásához, az epigenetikus szabályozó
faktorok jó részét is elsőként ecetmuslicában azonosították, a fejlődésért
felelős – homeotikus – gének regulátoraiként. Ezeket hagyományosan, a fejlődésre
gyakorolt hatásuk alapján sorolták két csoportba. A trithorax-csoportba
tartozó fehérjék nukleoszóma-mozgató vagy hiszton-módosító komplexeket
alkotnak, míg a Polycomb-csoport fehérjéi multimer (több fehérjéből álló)
represszor-komplexeket építenek fel. Mindeddig három ilyen represszor-komplexet
sikerült azonosítani, valamint felderítettek számos olyan DNS-szakaszt
is, melyekhez aktiváló, illetve inaktiváló hatású fehérjekomplexek képesek
kötődni.
További kutatások során megtalálták
a Polycomb- és a trithorax-csoport tagjainak homológjait egérben, illetve
emberben is. Arra is fény derült, hogy ezek a fehérjék nem csupán homeotikus
géneket, hanem számos más, a fejlődéshez elengedhetetlen gént szabályoznak,
illetve, hogy vérsejtekre jellemző transzkripciós faktorokkal együttműködve
mind ecetmuslicában, mind az emlősökben szerepet játszanak a vérsejtek
érési folyamataiban.
Hogyan jelölődhet a kromatin?
Melyek a „gátló” és melyek az „aktiváló” jelek? Először is, jelölődhet
maga a DNS: egyes fehérjék képesek metilcsoportokat kötni a DNS egyes bázisaihoz.
Az így jelölt DNS-en a transzkripció gátolt; a metiláció repressziós jel.
A hisztonfehérjéken mind aktiváló, mind gátló jelölés elhelyezhető. Tipikus
aktiváló jelölés például az acetil-csoportok elhelyezése, míg gátló jelölésként
szolgálhat például a metiláció. Mivel egy hiszton egyidejűleg többféleképpen
is megjelölhető, a hisztonok rendkívül sokrétű szabályozási folyamatokat
tesznek lehetővé. A különféle jelölések kombinációi egyfajta kódként szolgálnak
egy leolvasó rendszer számára, amelynek az a feladata, hogy értelmezze
a kódot, és kialakítsa az adott kromatinszakasz aktív, illetve inaktív
állapotát.
Az adott kromatinszakasz aktivitási állapotának kialakítása elsősorban a nukleoszómákon keresztül zajlik. Egyes aktiváló fehérjekomplexek képesek a nukleoszómákat elmozgatva szabad DNS-szakaszokat létrehozni, ezáltal a transzkripciós faktorok hozzáférhetnek kötőhelyeikhez. A gátló jel elhelyezésének és felismerésének mechanizmusával kapcsolatban felmerülő kérdésekre több mint egy évtizede keresik a választ. Mára már tudjuk, hogy ehhez a folyamathoz két külön fehérjekomplexre van szükség: az egyik komplex elhelyezi a „gátló” jelet a kromatinon, míg a másik leolvassa a jelet, és gátlás alá helyezi a kijelölt kromatinszakaszt. Úgy tűnik tehát, hogy mind az epigenetikus gátlás, mind az epigenetikus aktiváció több egymást követő, finoman szabályozott lépésen keresztül valósul meg (Müller és Kassis, 2006, 4. ábra).
Fontos megjegyezni, hogy egy adott kromatinszakasz aktivitására vonatkozó jelölések (például a hisztonok jelölései) sejtosztódásról sejtosztódásra megmaradnak. Ez az „epigenetikus memória” biztosítja a sejtek identitásának megőrzését az osztódások során.
A transzkripciós és az epigenetikus
szabályozás összefonódása
Hogyan működik együtt a
transzkripciós és az epigenetikus szabályozás? Hogyan szabályozza a vérsejtek
érését a kromatinszerkezet? Ezek nagyon nehéz kérdések, amelyekre ma még
nem tudunk kielégítő választ adni. Azonban némi betekintést nyerhetünk
e folyamatokba, ha alaposabban megvizsgáljuk egy kiragadott, de nagyon
intenzíven tanulmányozott vérsejt-típus, a B-sejtek keletkezésének és érésének
génszabályozási folyamatait.
A B-sejtek érési folyamatait három fő szakaszra oszthatjuk. Az első szakasz az elköteleződés, a második szakasz a sejtsors fenntartása, a harmadik pedig a terminális differenciálódás, melynek során a sejtek elnyerik végső identitásukat.
A limfoid irányba való elköteleződés
folyamatában az Ikaros- és a PU.1-fehérjék génszabályozó szerepe elsődleges
fontosságú. Olyan egerekben, melyekben ezek a gének mutációt hordoznak,
nem alakul ki limfoid leszármazási vonal, vagyis ezeknek az állatoknak
hiányoznak a limfocitái. Az Ikaros a génszabályozás során aktivátorként
és represszorként is működhet, attól függően, hogy milyen fehérjekomplexekkel
lép kapcsolatba.
A már korábban említett
EBF-, az E2A- és a Pax5-fehérjék a limfoid irányba elköteleződött sejtek
B-sejtté érését irányítják. Olyan géneket szabályoznak tehát, amelyek a
B-sejtek érési folyamataihoz elengedhetetlenek. Ilyen például a B-sejt
receptor egyik alegysége (IgA), vagy a B-sejt receptor jelátviteli tevékenységéhez
szükséges egyik fehérje génje (Cd19). Ezek a szabályozási folyamatok a
kromatin aktív szerkezetének kialakításán keresztül valósulnak meg.
Az IgA gén bekapcsolása több lépésben történik. Először az EBF és az E2A előkészítik a terepet: eltávolítják az IgA gént szabályozó DNS-szakaszról a metilcsoportokat, majd nukleoszóma-mozgató komplexekkel együttműködve nukleoszóma-mentesítik a lókuszt. A Pax5 ekkor képes hozzákötni kötőhelyéhez, és beindítja a gén átírását. Látható tehát, hogy a gének aktivációja során az epigenetikus, illetve transzkripciós szabályozás precíz együttműködésére van szükség.
Míg a B-sejtek elköteleződéséért az EBF- és az E2A-fehérjék a felelősek, a B-sejtek sorsának fenntartásában a Pax5-fehérjének jut kitüntetett szerep. Ez a fehérje számos olyan gént aktivál, amelyek a B-sejtek működéséhez (jelátvitel, vándorlás, letapadás, antigén bemutatás) elengedhetetlenül szükséges fehérjéket kódolnak, ugyanakkor képes represszálni olyan géneket, amelyek más típusú sejtek (pl. a makrofágok) működéséhez szükségesek, de a B-sejtekben nincs rájuk szükség. Az általa megvalósított pozitív, illetve negatív szabályozási folyamatokban a Pax5 különféle komplexekkel kapcsolatba lépve képes a kromatin szerkezetét a megfelelő „nyitott”, vagy „zárt” irányba módosítani.
A Pax5 tulajdonképpen a B-sejtek identitásának „őrzője”: a pro-B-sejttől az érett B-sejtig fokozatosan fejeződik ki. Érdekes módon maga az E2A és az EBF is részt vesz a Pax5 aktivációjában. Amikor a Pax5 aktívvá válik, részben olyan géneket kapcsol be, amelyek önmaga aktivátorai, vagyis pozitív visszacsatolás történik, ami biztosítja a gén folyamatos aktív állapotát. A nem B típusú sejtekben a Pax5-fehérje génjét a Polycomb-csoport tagjai által felépített represszor-komplex tartja kikapcsolt állapotban.
A B-sejtek érésének utolsó
szakasza a terminális differenciálódás. Miután az immunglobulin receptor
a B-sejtek membránjának felszínén megjelenik, a sejtek csaknem teljesen
érettek. Ha nem érkezik semmilyen jel, ami arra utalna, hogy a szervezetbe
betolakodó lépett, a B-sejtek „pihenő” állapotba kerülnek. Aktiváció hatására
a B-sejtekkel két dolog történhet: vagy ellenanyagtermelő plazmasejtekké
válnak, vagy részt vesznek a csíraközpont képzésében. Ezeket a folyamatokat
két egymást kizáró fehérje (a BCl6 és a Blimp1) szabályozza. Molekuláris
vizsgálatok bizonyították, hogy ezek a fehérjék is nukleoszóma-mozgató
és hiszton-módosító komplexekkel lépnek kapcsolatba, és ezek segítségével
fejtik ki génszabályozó hatásukat (5. ábra).
Nyilvánvaló tehát, hogy
a transzkripciós és epigenetikus szabályozási folyamatok nem választhatók
külön egymástól, hanem szorosan összefonódnak; a szabályozás két egymásra
épülő, illetve egymástól függő szintjét jelentik (Parra, 2009).
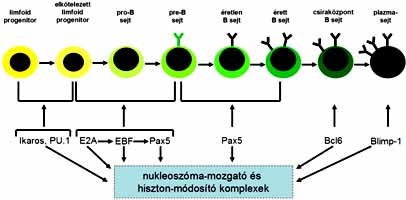
5. ábra. A B-sejtek érési
szakaszai az elköteleződéstől az érett
B-sejtekig. Az egyes
sejtalakok alatt az adott érési fázist irányító
fehérjefaktorok neveit
tüntettük fel. Ezek a faktorok különféle
nukleoszóma-mozgató és
-módosító komplexekkel kapcsolatba lépve
fejtik ki aktiváló, illetve
gátló hatásukat a B-sejtek érését
befolyásoló célgéneken
Az ecetmuslica mint a
vérsejtképződés modellje
Vajon alkalmas az ecetmuslica
arra, hogy a segítségével ehhez hasonlóan bonyolult folyamatot hatékonyan
modellezhessünk? A válasz igen. Az ecetmuslica genetikai háttere óriási
tárházát biztosítja azoknak az eszközöknek, amelyeket az epigenetikus és
transzkripciós szabályozás tanulmányozásának szolgálatába állíthatunk.
Számos olyan mutáns törzs létezik, melyben a kromatinon keresztül megvalósuló
szabályozási folyamatok sérülnek, sőt ezeknek a mutációknak gyakorlatilag
bármely kombinációja könnyedén előállítható. Az ecetmuslica lehetőséget
nyújt arra is, hogy megvizsgáljuk a transzkripciós faktorok hiányának,
illetve túltermelésének molekuláris és élettani következményeit.
Amint korábban is említettük, nagyon gyakran az ecetmuslica volt a kísérleti alanya a szabályozási folyamatok megismerésének, és az itt tett felfedezéseket csak később terjesztették ki az emlősökre. Az utóbbi évek eredményei szerint az ecetmuslica vérsejtjeinek képződését és érését az emlősökéhez hasonló epigenetikus faktorok szabályozzák; többek között a Polycomb-fehérjék, illetve nukleoszóma-mozgató komplexek.
Az egyik legintenzívebben kutatott részterület a lamellociták keletkezésének szabályozása. Ezek a sejtek immunindukció nélkül csak nagyon ritkán figyelhetők meg a lárvák keringésében, viszont gyakran keletkeznek spontán olyan mutánsokban, amelyekben az epigenetikus represszió (gátlás) sérült. Mindez arra utal, hogy a lamellocita sejtsors a lárvában epigenetikus gátlás alatt áll. Éppen ezért a lamellociták keletkezésének a folyamata kiválóan használható az epigenetikus gátlás vérsejtsors kialakításában betöltött szerepének tanulmányozására.
Ezen túl felfedeztek ecetmuslicában egy olyan „epigenetikus kapcsolót” is (a Spen fehérjét), mely képes a fertőzésekre reagálva átprogramozni számos gén kromatinszerkezetét úgy, hogy ennek hatására a vérsejtek osztódni és differenciálódni kezdjenek, hogy minél hatékonyabban megküzdhessenek a betolakodóval.
Talán a leírtakból is kitűnik,
hogy könnyű kezelhetőségével, kidolgozott genetikai rendszerével, és az
emlősökéhez nagyon hasonló immunrendszerével az ecetmuslica ideális modellszervezet
ahhoz, hogy a vérsejtek keletkezését, érését, illetve ezen folyamatok szabályozását
tanulmányozzuk. Az is nyilvánvaló, hogy a vérsejtek érési folyamatait csak
úgy érthetjük meg, ha a transzkripciós és az epigenetikus szabályozás egymással
szoros kapcsolatban álló folyamatait egyszerre vizsgáljuk.
IRODALOM
Evans C.J.–Banerjee U.:
Transcriptional regulation of hematopoiesis in Drosophila. Blood Cells
Mol. Dis. 2003; 30: 223–8.
Evans C.J.–Hartenstein V.–Banerjee
U.: Thicker than blood: conserved mechanisms in Drosophila and vertebrate
hematopoiesis. Dev. Cell 2003; 5: 673–90.
Hartenstein V.: Blood cells
and blood cell development in the animal kingdom. Annu. Rev. Cell. Dev.
Biol. 2006; 22: 677–712.
Honti V.–Csordás G.–Márkus
R.–Kurucz É.–Jankovics F.–Andó I.: Cell lineage tracing reveals the plasticity
of the hemocyte lineages and of the hematopoietic compartments in Drosophila
melanogaster. Mol. Immunol. 2010 május 17.
Honti V.–Kurucz É.–Csordás
G.–Laurinyecz B.–Márkus R.–Andó I.: In vivo detection of lamellocytes in
Drosophila melanogaster. Immunol. Lett. 2009; 126: 83–84.
Márkus R.–Laurinyecz B.–Kurucz
É.–Honti V.–Bajusz I.–Sipos B.–Somogyi K.–Kronhamn J.–Hultmark D.–Andó
I.: Sessile hemocytes as a hematopoietic compartment in Drosophila melanogaster.
Proc. Natl. Acad. Sci. USA 2009; 106: 4805–9.
Martinez-Agosto J.A., Mikkola
H.K., Hartenstein V., Banerjee U.: The hematopoietic stem cell and its
niche: a comparative view. Genes. Dev. 2007; 21(23): 3044–60.
Müller J., Kassis J.A.:
Polycomb response elements and targeting of Polycomb group proteins in
Drosophila. Curr. Opin. Genet. Dev. 2006; 16(5): 476–84.
Parra M. Epigenetic events
during B lymphocyte development. Epigenetics 2009; 4(7): 462–8.
| Természet Világa, | 142. évfolyam, 3. szám,
2011. március
https://www.termvil.hu/ https://www.chemonet.hu/TermVil/ |