SZABAD JÁNOS
Mi van beleírva
kromoszómáinkba?
Minden gén minden
sejtben?
A
kromoszómák, vagy kromoszómarészek vesztése a testi sejtek differenciálódása
során jól ismert jelenség az alacsonyabb rendű élőlények világában. Az ún.
kromatin diminúció során egész kromoszómák, vagy csak kromoszómarészek előbb
tömör kromatin-gombolyagokká válnak, amelyek aztán elvesznek a sejtosztódások,
a sejtdifferenciáció folyamán, és hiányoznak azokból a sejttípusokból,
amelyekben nincs szükség az elveszett gének funkciójára. A kromatin diminúció
megszokott esemény pl. a papucsállatka, a lóbélgiliszta, sok levéltetű és
evezőslábú rákfaj, a sötétszárnyú gombalégy, vagy a folyami ingola testi
sejtjeiben. Ám sohasem történik meg az ősivarsejtekben, amelyekből a faj
fennmaradásához szükséges ivarsejtek képződnek. Vajon a kromatin diminúció
jelensége létezik a magasabb rendű élőlények életében is?
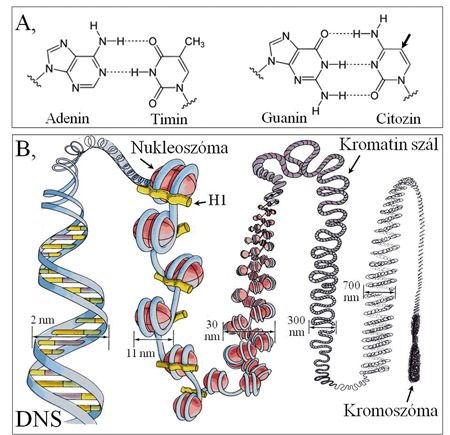
1.
ábra. Bázispárok, DNS és kromatin. (A) A
két bázispár. A genetikai információt a bázispárok sorrendje jelenti a DNS-ben.
(A citozin nyíllal jelölt pozíciója metilálható.) (B) A DNS-molekula
hisztonfehérjékből álló labdacsokra tekeredve nukleoszómákat alkot. A hiszton-1
(H1) -molekula stabilizálja a nukleoszómákat, és kapcsolatot teremt a kromatint
alkotó fehérjeféleségek egyikével-másikával. A DNS-hez és a nukleoszómákhoz további
fehérjék csatlakoznak, kialakítva a kromatint, a kromoszómák anyagát. Egy
kromoszóma tízezerszer rövidebb, mint a benne levő DNS
Az
a tény, hogy jószerivel bármely növény bármely testi sejtjéből szaporodóképes
növényt lehet regenerálni, azt mutatja, hogy a növények sejtjeiből nem vesznek
el sem kromoszómák, sem pedig kromoszómarészek. Azok a kísérletek is erre a
következtetésre vezettek, amelyekben állatok testi sejtjeinek magjait ültették
olyan érett petesejtekbe, amelyek sejtmagját eltávolították. A „mesterséges”
zigóták egyikéből-másikából szaporodóképes állatok fejlődtek. E technika nyomán
született pl. Dolly, a híres jerke 1996-ban. (Zárójelben jegyezzük meg, hogy
Dolly 277 próbálkozásból az egyetlen sikeres volt. Vajon miért volt oly’
csekély a kísérlet hatékonysága?) Az itt említett eredmények alapján
nyilvánvaló, hogy léteznek olyan mechanizmusok, amelyek azt biztosítják, hogy
testi sejtjeink differenciálódása során azok a gének örökre „bezárulnak”,
amelyek funkciójára bennük nincs szükség. Azok viszont „üzemképesek” maradnak,
amelyek funkcionálnak az illető típusú testi sejtben. Melyek a géneket
„becsukó” és „nyitva tartó” mechanizmusok?
Kromatin nyitva,
csukva

2.
ábra. Hisztonok, nukleoszómák, lizin. (A)
A DNS 164 bázispárnyi szakasza a nyolc hiszton- (két-két H2A, H2B, H3 és
H4) fehérjéből álló labdacsra tekeredve egy nukleoszómát alkot. A
hisztonmolekulák végei kiállnak a nukleoszómákból. (B, C) A hisztonok végeiben
gyakoriak a lizin (K) aminosavak. (N és C a fehérjék két végét jelzi, a számok
pedig azt, hogy az illető aminosav hányadik a fehérjét alkotó aminosavak
sorrendjében.) A lizinek oldallánca metilálható (Me), acetilálható (Ac), a
szerinek (S) foszoforilálhatóak (P). (Ub az ubiquitin kis fehérjemolekula
jele.) (D) A lizin oldalláncának végén levő pozitív töltésű nitrogén (N+)
kapcsolódik a DNS negatív töltésű foszfátcsoportok egyikével. A lizin
nitrogénjéhez metil- (egy, kettő, vagy akár három), vagy acetilcsoport
kapcsolódhat. Az acetilált lizin nitrogénje elveszti töltését
A
lizinekre – enzimek révén – metil- vagy acetilcsoportok „aggathatók”, illetve
távolíthatók el, befolyásolva a nukleoszómák stabilitását. A szerinekre enzimek
foszfátcsoportokat vihetnek, és távolíthatnak el (2. ábra). A
nukleoszóma-füzérhez sok-sok további fehérjeféleség csatlakozik, és együttesen
alkotják a kromatint, a kromoszómák anyagát. A kromatinfehérjék a sejt
életszakaszának megfelelően tömörítik, vagy lazítják a kromatint, vagy gyakorta
csak egyes szakaszait. Minél tömörödöttebb a kromatin, annál kevésbé, vagy
egyáltalán nem hozzáférhetőek a gének. A viszony fordítva is igaz: a laza
kromatinban levő gének kifejeződhetnek, a bennük tárolt genetikai információ
kibontható.
A
hisztonok lizinjeinek metilációja, attól függően, hogy melyik lizin
metilálódik, és hogy hány metilcsoport kapcsolódik a lizin nitrogénjéhez,
tömörebbé vagy lazábbá is teheti a kromatint. Általánosságban elmondható, hogy
a hiszton-3 negyedik helyén levő lizin (H3K4) metilációja a gének
aktiválódásával jár. Ugyanennek a lizinnek a kétszeres metilációja nyomán a kromatin
tömörödik, és elmarad a transzkripció, vagyis az átírás. A H3K9 és a H3K27
metilációja a gének inaktiválódását okozza. Ám a hisztonmetiláció bonyodalmas
jelenség. A H4K20 lizin egyszeres metilációja a kromatin tömörödésével, a
transzkripció elmaradásával jár. Ha ugyanez a lizin kétszeresen metilált, egy
olyan fehérjemolekula-féleség kapcsolódik hozzá, amely létfontosságú a
kettősszálú DNS-törések javításában. Ha a H4K20 háromszorosan metilált, a
kromatin roppant erősen tömörödik. (Zárójelben jegyezzük meg, hogy ismertek
olyan rákos daganatféleségek, amelyekben a H4K20 háromszorosan metiláltságának
szintje csökkent, illetve elmaradt.) A metiláció fontosságát tovább bonyolítja
az a tény, hogy a metilált lizinekhez olyan fehérjeféleségek kapcsolódhatnak, amelyek
a kromatint lazítják, vagy éppen tömörítik.
Bizonyosra
vehető, hogy a metiláltság szintje függ a környezeti hatásoktól. Leírták
például, hogy félelem hatására a patkányok hippokampusz-sejtjeiben a H3K4 lizin
háromszorosan metilálódik. Általánosan elfogadott vélemény, hogy a hisztonok
metilációjának – más epigenetikus folyamatokkal egyetemben – fontos szerepe van
az öregedésben, a különféle degenerációs betegségek kialakulásában, valamint az
intellektuális képességek csökkenésében is.
A
hisztonok lizinjeinek acetilációja nyomán elvész a nitrogén pozitív töltése (2.
ábra). Az acetiláció következményeként csökken a DNS kötődésének erőssége a
hisztonlabdacsokhoz, a DNS-hez olyan fehérjeféleségek férkőzhetnek, amelyek
beindítják a transzkripciót. Ismeretes például, hogy a H3K9 és a H3K14
acetilációja transzkripciót eredményez. Vannak olyan fehérjemolekula-féleségek
is, amelyek felismerik az acetilált lizineket, kapcsolódnak hozzájuk, és
szabályozzák a kromatin szerveződését. A hisztonok acetilációját az ún. hiszton
acetiltranszferáz, és az acetilcsoportok eltávolítását a hiszton deacetiláz
enzimek végzik. Eme enzimek funkcióját befolyásolva akár segíteni lehet beteg
embertársainkon. Például a fenilvajsav, ami a hiszton deacetiláz aktivitását
gátolja, nyitott kromatint, és oly’ intenzív transzkripciót eredményez, amely
végeredményben lehetővé teszi azoknak a fehérjemolekuláknak a lebontását,
amelyek felhalmozódása Huntington-kór kialakulásához vezet.
A
szerinek foszforilációja nyomán nemcsak a foszforilált hisztonmolekula
szerkezete és funkciója változik meg jelentősen, hanem a hozzájuk kapcsolódó
fehérjék típusai is. Általánosan elfogadott vélemény, hogy a hisztonok
foszforilációját a kromatin kondenzációja, tömörödése követi. Pl. a H3S10
foszforilációja a kromatin tömörödését, a mitózisra készülődést jelzi. A
hisztonok foszforilációjának jelentősége van a DNS-hibák javítgatásában,
valamint a sejtek programozott halálában is.
DNS-metiláció

3.
ábra. DNS metiláció. A DNS metilációja során valamelyik metiltranszferáz enzim
metil- (CH3) csoportokat visz a DNS-re, tömörítve a kromatint, egyben
csökkentve, vagy akár megszüntetve a gének hozzáférhetőségét. A demetiláció
során metilcsoportok távolítódnak el a DNS-ről, miáltal a gének hozzáférhetővé
válhatnak. Vannak olyan enzimek, amelyek a replikáció folyamán képződő új
DNS-szálakat az eredeti mintázat szerint metilálják, fenntartva a DNS
metiláltságát
A
DNS metiláltsága lényegében megszűnik az ivarsejtek, a zigóták képződése során,
ám újraalakul az embriógenezis, a sejtek differenciálódása folyamán, miközben
azok a gének be-, illetve kikapcsolhatók maradnak, amelyek funkcióját a sejtek
igénylik, azok pedig örökre zárva maradnak, amelyek termékére nincs szükség az
illető sejttípusban.
A DNS metilálódását, demetilálódását környezeti hatások is befolyásolják. Bizonyított tény, hogy a DNS metiláltsága jelentősen különbözik a dohányzók és a sohasem dohányzott emberek vérmintáiban. Több mint kétezer olyan génünk van, amelyek metiláltsága jelentősen különbözik a kétféle ember között. A különbség nemcsak a DNS metiláltságában érhető tetten, hanem a gének kifejeződés-mintázatában is. Bizonyosra vehető, hogy sok, a dohányzással kapcsolatos daganatféleség epigenetikai változás nyomán képződik. Az említett gének között vannak olyanok, amelyek metiláltásga a dohányzás abbahagyása után fokozatosan visszaáll a normális szintre, ám bőven vannak olyanok is, amelyek metiláltsága 22 évvel a dohányzásról leszokás után is eltér a normálistól. Az sem meglepő, hogy a várandósságuk alatt dohányzó nők gyermekeinek vérmintáiban is kimutatható a különbség a DNS metiláltságában a nemdohányzók gyermekeihez képest. Sőt, a különbség nemcsak újszülöttek vérmintáiban, hanem még 8-éves gyerekekében is kimutatható. Tavaly megjelent tudományos közlemények azt valószínűsítik, hogy a különbség – egyebek mellett – a gyerekek olyan nyomorúságainak is oka lehet, mint a nyúlszáj kialakulása, vagy az asztma.
Vörös-fekete tarka
macskák
A gének örökre kikapcsolásának jól ismert típusa az egyik X kromoszóma inaktivációja a gerincesek nőstény embrióiban. Azért, hogy a nőstények (XX) és a hímek (XY) sejtjeiben az X kromoszómák génjeinek termékéből ugyanannyi legyen, a nőstények egyik X kromoszómája (java részben, de nem teljesen) inaktiválódik. (Az X kromoszóma inaktiváció mechanizmusát a bekeretezett szöveg mutatja be.) Az X kromoszóma inaktiváció jelenségét alighanem a vörös/fekete tarka macskákkal lehet legjobban illusztrálni. A macskák bundaszínét egy X kromoszómához kapcsoltan öröklődő gén szürke, vörös és fekete változatai, alléljai határozzák meg. Ha például egy nőstény macskákban az egyik X kromoszóma bunda színét meghatározó génje a fekete (Xf), a másik X a gén vörös változatát hordozza (Xv), két lehetőség van. Ha valamely sejtben az Xf kromoszóma inaktiválódik, úgy az Xv hordozó marad aktív. Az ilyen sejt utódsejtjeiből a bunda egy vörös foltja fejlődik. Az olyan sejt leszármazottaiból viszont, amelyekben az Xv kromoszóma inaktiválódik, és az Xf marad aktív, a bunda egy fekete foltja képződik (4. ábra).

4.
ábra. Vörös/fekete/fehér tarka macskák. Az ábrán bemutatott macskák
mindegyikének két X kromoszómája van. Az egyik a bunda fekete, a másik a bunda
vörös színét kódolja. Annak a sejtnek a leszármazottaiból, amelyben a fekete
színt kódoló X kromoszóma inaktiválódik, vörös folt képződik. Abból a sejtből
pedig fekete folt ered, amelyben a vörös színt kódoló X kromoszóma
inaktiválódik. (A fehér foltok az X kromoszóma inaktivációtól független esemény
nyomán képződnek.)
Ahány
tarka macska, a foltok eloszlása annyi féle, amiből arra következtethetünk,
hogy az X kromoszóma inaktiváció véletlenszerűen következik be (4. ábra). A
bundán csak kevés folt van, ám ezek nagyok, ami azt jelenti, hogy az X
kromoszóma inaktiváció az embriógenezis korai szakaszában következik be. Akkor,
amikor az embrió még csak néhány sejtből áll, és egy-egy sejtből sok utódsejt
származhat. A nagy foltokon belül nincsenek apróbbak, ami azt mutatja, hogy az
X kromoszóma inaktiváció irreverzibilis, vissza nem fordítható esemény, az
inaktiválódott gének örökre bezáródtak. Minthogy a foltok határai élesen
rajzolódnak ki és nem elmosódottak, arra is következtethetünk, hogy az X
kromoszóma inaktiváció ún. sejtautonóm módon történik: a sejt saját döntése, és
nincsenek rá hatással a szomszédos sejtek. Az X kromoszóma inaktiváció az ember
lányembriókban is megtörténik. Tankönyvi példa az olyan lányok esete, akik
testéről foltokban hiányoznak a verejtékmirigyek (5. ábra).
Az
egypetéjű ikrek vizsgálata is szépen mutatja a környezeti hatások és az
epigenetika közötti kapcsolatot. Amíg ugyanis a fiatal egypetéjű ikrek DNS-ének
metilációs mintázata meglehetősen hasonlít, életkoruk előre haladtával egyre
jobban különbözik. A különbség különösen az olyan esetekben szembetűnő,
amelyekben az ikrek eltérő körülmények között élik életüket. Sokan úgy
gondolják, hogy a betegségekkel szembeni eltérő fogékonyságuk oka is
epigenetikus eredetű.

5.
ábra. Verejtékmirigyekben hiányos mozaikok. Az ábrán bemutatott egypetéjű
ikerlányok egyik X kromoszómája
verejtékmirigyek képződést kódolja, a másik nem, mert a mirigyek
képződését kódoló génje meghibásodott. Ha az ép gént hordozó X kromoszóma
inaktiválódik, és a mutáns változatot hordozó marad aktív, olyan foltok
képződnek, amelyek területén nincsenek verejtékmirigyek (világosbarnával
jelölve). Fordított esetben viszont képződnek verejtékmirigyek a mozaikfoltok
területén
Az X kromoszóma
inaktivációja
Igen, vannak. A klasszikus példa a Prader–Willi- és Angelman-szindrómák esete. A Prader–Willi- és az Angelman-szindrómás emberek genetikai tartalma azonos: mindkettőjükből hiányzik a 15. kromoszóma egy 4 milliónyi bázispárból álló szakasza. És bár a másik 15. kromoszóma eme részén levő gének épek, minthogy máskén vannak előprogramozva az anyai és az apai eredetűek, különös szindrómákat mutató embertársaink fejlődnek (6. ábra). A Prader–Willi-szindrómás emberekben az apai eredetű SNRPN (Small Nuclear Ribonucleoprotein-Associated Protein N) gén eleve hiányzik, az anyai eredetű viszont úgy van előreprogramozva, hogy ne funkcionáljon. Vagyis a Prader–Willi-szindrómás emberekből lényegében hiányzik az SNRPN gén. Az SNRPN gén terméke a pre-mRNS-molekulák szövetspecifikus érésében játszik fontos szerepet. Az Angelman-szindrómás emberekből pedig az UBE3A (az ubiquitin protein ligase E3A) gén funkciója hiányzik. Az anyai eredetű a 4 milliónyi hiányzó bázispár miatt eleve hiányzik, az apai eredetű pedig bár jelen van, nem funkcionál (6. ábra). Azért nem, mert a spermatogenezis folyamán genetikai bevésődés történik, amely kikapcsolja a gént. Az UBE3A gén terméke egy olyan enzim, amelynek a fehérjék lebontásában van fontos szerepe, különösen az agy egyes területein, ahol csak az anyai eredetű UBE3A gén aktív. A génfunkció hiányában érthető az Angelman-szindrómásak különös viselkedése.

6.
ábra. Prader–Willi- és Angelman-szindróma. Az azonos genetikai tartalmak
következményei attól függenek, hogy az ép géneket hordozó kromoszóma anyai,
vagy apai eredetű-e. Minthogy a gének másként vannak előprogramozva a petesejt,
illetve a spermiumok képződése során, eltérően funkcionálnak az utódokban. A
Juan Carreño „La Monstrua Desnuda” című festményén (1860) bemutatott Eugenia
Martinez Vallejo (Prado múzeum, Madrid) minden bizonnyal
Prader–Willi-szindrómás volt. Minthogy nem ismerik a jóllakottság érzését, és
kényszeres evők, hatéves korukra elhíznak. Alacsonyak, arcuk kerek, szemeik
mandulavágásúak, nemi szerveik fejletlenek, szellemi fejlődésük visszamaradott.
A Gian Francesco Caroto (1480–1555) „Gyermek portréja rajzzal” című festményén
(Castelvecchio Museum, Verona) ábrázolt gyerek minden bizonnyal az
Angelman-szindróma tüneteit mutatta: fejlődésben visszamaradt, beszéd- és
egyensúlyzavarai voltak, boldogságban úszott, gyakran nevetett, mosolygott,
koncentrálóképessége csekély volt
A
genetikai bevésődés tehát lényegében olyan, az ivarsejtek képződése során
történő szabályszerű esemény, amely a DNS és/vagy a kromatin módosítása révén
befolyásolja az utódok életét. Kérdés, hogy vannak-e olyan környezeti hatások,
amelyek epigenetikai módon befolyásolják az utódok, vagy talán még az utódok
utódainak életét is? Igen, vannak. Íme, néhány példa. Miközben ketrecükbe
cseresznyevirág illatát fújtak, áramütésekkel sokkoltak egereket. A két hatás
között hamar kialakult az ún. pavlovi reflex: a cseresznyevirág illatát
megérezve az egerek pánikreakciót mutattak. Különös, hogy cseresznyevirág-illat
hatására a kezelt egerek utódai is pánikba estek, bár őket sohasem
elektrosokkolták. A jelenséget a kutatók annak az M71 jelű génnek az
epigenetikai bevésődésével magyarázzák, amely gén terméke a cseresznyevirág
illatának specifikus receptora. Sőt, a szülők és utódaik agyában nagyon hasonló
típusú változások is kimutathatóak voltak.
Leírták,
hogy a patkányok alaptermészetét erősen befolyásolja, hogy életük kezdetén
mennyit nyalogatja őket anyjuk. Minél nagyobb az anyai gondoskodás mértéke,
annál sikeresebbek az utódok. Az anyai gondoskodás az utódok
DNS-metiláltságában is kimutatható. Talán meglepő, de a patkányok génjeinek
megfelelő emberi génekben is kimutathatóak az epigenetikai hatások. Öngyilkosok
génjeit vizsgálva kiderült, hogy egész más volt a DNS metilációs mintázata
azokéban, akiket gyerekkorukban bántalmaztak, mint a kontrollcsoportban. Nem
hiába mondják a szakemberek, hogy gyermekeink életének első éveiben semmi sem
fontosabb, mint a szerető, elfogadó és bátorító családi környezet. Az
elmondottakkal összecsengenek azoknak a vizsgálatoknak az eredményei is, amelyek
azt írták le, hogy a holokausztot túlélők gyermekeinek génjeiben kimutathatóak
a szülőket ért traumák. Vagy például a bételt rágó szülők gyermekei, akik
sohasem rágtak bételt, sokkal gyakrabban szenvednek olyan
anyagcsere-betegségekben, amelyek a kontrollcsoportban jószerivel ismeretlenek.
Úgy tűnik, hogy fiatalon a dohányzás rabjaivá váltak gyermekei 5–10 kilóval
nehezebbek, mint a sohasem dohányzott szülők gyermekei. (Noha szüleik nem
voltak elhízottak.)
Bizonyítottnak
vehető, hogy vannak olyan génjeink, amelyek epigenetikusan őrzik, és utódainkra
örökítik a környezeti hatásokat. A legújabb vizsgálatok azt mutatják, hogy
mintegy 100 olyan génünk van, amelyek aktivitása genetikai bevésődés révén
szabályozott. Közöttük kétszer annyi az apai, mint az anyai ágon
előreprogramozott gén (https://www.geneimprint.com/site/genes-by-species).
Ismertek
olyan esetek is, amelyekben a genetikai bevésődés nemcsak egyetlen, hanem több
generációra is epigenetikusan öröklődik. Normális körülmények között ugyanis az
epigenetikai program az ivarsejtek, a meiózis során törlődik, hogy aztán az
embriógenezis folyamán újraalakuljon. Vannak viszont olyan gének, amelyek
epigenetikus státusza mintegy „túléli” az ivarsejtek képződését, és
változatlanul megy generációról generációra. A legismertebb példa alighanem a
gyujtoványfű (Linaria vulgaris) ún. tortamutánsának öröklődése (7. ábra). Amíg
a vadtípusú növény virágai kétoldali szimmetrikusak, addig a
tortamutáns-változat, mint a torták, sugarasan szimmetrikus (8. ábra). Bár a
kétfajta virágú növény Lcyc génjében a bázispárok sorrendje azonos, a
tortamutáns-változat Lcyc génje erősen metilált, ami miatt nem funkcionál.
Olyan, mintha nem is létezne. A tortamutáns-jelleg – mint egy mutáció –
recesszív tulajdonságként öröklődik generációról generációra. Meg-megesik, hogy
a tortamutáns gyújtoványfüvektől olyan növények származnak, amelyek virágai
vadtípusúak, kétoldali szimmetrikusak. Az ilyen növények Lcyc génje nem
metilált, és ellátja funkcióját.

7.
ábra. Vadtípusú és tortaszimmetrikus virágok. Amíg a gyujtoványfű (Linaria
vulgaris) és a tátika (Antirrhinum majus) vadtípusú virágai kétoldali
szimmetrikusak, addig a tortamutáns-változat virágai – mint a torták –
sugarasan szimmetrikusak. Azért, mert a gyujtoványfű Lcyc, valamint a tátika
cycloidea génje funkciójának hiányában csupa ventrális típusú sziromlevelek
képződnek (melyeket nyilak mutatnak)
Az
Lcyc gén annak a cycloidea génnek a megfelelője, amely funkciója a tátika
virágaiban a dorzális sziromlevelek és porzók kialakulását szabályozza (8.
ábra). A cycloidea gén funkciójának hiányában tortamutáns tátikavirágok
képződnek: a dorzális sziromlevél- és porzókezdemények a ventrális programot
hajtják végre, és végeredményben csupa olyan ventrális jellegű sziromlevél
képződik, amelyek elrendeződése szimmetrikus.

8.
ábra. A vadtípusú és a tortamutáns virágok szerkezete. A
tortamutáns-változatban a cycloidea gén funkciójának hiányában a dorzális
(felülső) sziromlevelek és a porzók a ventrális (alulsó) fejlődési programot
hajtják végre
Úgy tűnik, hogy az emberek esetében is vannak generációkon átnyúló epigenetikus hatások. A második világháború idején éhező hollandok unokái között négyszer több volt a cukorbeteg, mint a kontrollcsoportban. Vagy például a XIX. században a svédországi éhínség idején éhező férfiak fiúunokái között ritkák voltak azok, akik keringési rendellenesség miatt haltak meg.
1865 óta, midőn Mendel feltárta az öröklődés törvényszerűségeit, a
jelenség további érdekes aspektusait ismertük meg, köztük az epigenezist.
Általa a környezet és a tulajdonságok öröklődése közötti kapcsolat fontosságát
értettük, értjük meg.
| Természet Világa, | 148. évfolyam, 6. szám,
2017. június http//www.termvil.hu/ |