MEZŐ GÁBOR−KISS
KRISZTINA−BIRI-KOVÁCS BEÁTA−OLÁHNÉ SZABÓ RITA
Személyre szabott
rákgyógyítás
A
daganatos megbetegedések okozta halálozások száma Magyarországon a korábbi
növekvő tendencia után 2013 óta stagnál, valamivel kevesebb, mint 32 800
eset/év. Ez akár jónak is mondható, ha azt vesszük figyelembe, hogy a
megbetegedések száma közben növekszik. A gyógyulásra való esély növekedésének
okai az egyre jobb diagnosztikai és terápiás lehetőségek. Azonban
elégedettségre nem lehet okunk, mert még mindig nálunk figyelhető meg az egyik
legrosszabb statisztika ezen a területen Európában. Ezért nagyon fontos, hogy a
tumorterápiával kapcsolatos kutatások megkülönböztetett figyelmet és támogatást
kapjanak Magyarországon is. Különösen a magas mortalitású tumorok esetén lenne
szükség nagy áttörést hozó új eredményekre. Daganatos megbetegedések közé
tartoznak a tüdő- és légzőszervi tumorok, a vastagbél és az emésztőrendszer
rosszindulatú daganatai, az emlő- és hasnyálmirigy-tumorok. Az emlőtumorok, ha
időben diagnosztizálják azokat, elég jól gyógyíthatóak, és az esetek több mint
kétharmadában teljes gyógyulás vagy 5 évnél hosszabb túlélés érhető el. Ebben
az esetben a nagy esetszám miatt jelentős a halálozások száma. A másik véglet a
hasnyálmirigy rosszindulatú daganata, amely ugyan kis esetszámban fordul elő,
de a legpusztítóbb rákfajta, csupán az esetek 5%-ában lehet öt évnél hosszabb
túlélést elérni.

Hatóanyag - irányító molekula-konjugátumok

1.
ábra. A három vegyülettár (hatóanyag, linker, irányító molekula) és a belőlük
felépíthető konjugátumok vázlatos képe. A komponensek számának növelésével a
variációs lehetőségek száma jelentős mértékben nő
Kutatócsoportunk
arra vállalkozott, hogy három olyan vegyülettárat állít elő (1. tumorellenes
hatóanyagok; 2. irányító molekulák; 3. az előző kettőt összekapcsoló bifunkciós
linkerek), amelyek nagy variabilitással kapcsolhatók egymáshoz, így akár 100
különböző gyógyszerjelölt molekulát is könnyen elő lehet állítani. Ezek a
gyógyszerjelöltek alkalmasak lehetnek a magas mortalitású tumorok hatékony,
személyre szabott, célzott terápiájára.
Mit
takar a személyre szabott célzott tumorterápia? A módszer, amelyet célzott vagy
irányított daganatterápiának neveznek, azon alapszik, hogy olyan anyagokkal
támadják a ráksejteket, amelyek nagy szelektivitással ismerik fel a beteg
sejteket. Ezzel az eljárással az egészséges szövetek megkímélhetőek, csökkentve
a terápia káros mellékhatásait és javítva a paciens életminőségét a kezelés
alatt. Ez nagy előrelépés lenne a jelenleg alkalmazott kemoterápiás
eljárásokhoz képest, ahol a gyógyszermolekulák bejuthatnak nemcsak a ráksejtekbe,
hanem az egészséges sejtekbe is, amelyekre szintén toxikus hatásúak.
Természetesen ahhoz, hogy ezt a terápiát hatékonyan lehessen alkalmazni,
ismerni kell az adott daganaton azokat a molekulákat (pl. receptorokat),
amelyek támadhatók a rák elpusztításának reményében. Ezeket a molekulákat a
daganat eltávolítása, vagy biopsziás szövettani mintavétel után speciális
vizsgálatokkal határozzák meg. Azt is érdemes hangsúlyozni, hogy egy szervtípus
(pl. tüdő, hasnyálmirigy) rákos megbetegedésekor sem biztos, hogy azonos
tumorról beszélünk. A különböző tumortípusok esetén pedig más-más gyógyszerre
lehet szükség. Leegyszerűsítve, két különböző hasnyálmirigytumor-sejt (pl.
Panc-1 és MiaPaca2) más-más receptorkészlettel rendelkezhet, tehát más-más
irányító molekulák lesznek alkalmasak arra, hogy a kiválasztott és az adott
sejten hatásos hatóanyagot, amelyek szintén lehetnek különbözőek, célba
juttassa. Ahogy azt a 2011-ben megjelent cikkünkben bemutattuk, a sejtfelszíni
receptorokon keresztül történő gyógyszer célba juttatásának hatékonyságát
korlátozhatja az, hogy a ráksejteken a receptorok száma limitált. Ezért a
vegyület koncentrációjának növelése nem feltétlenül vezet a hatékonyság
növekedéséhez. Megoldás lehet, ha a daganatellenes szereket különböző irányító
molekulákhoz kapcsoljuk, amelyek eltérő receptorokat ismernek fel a
ráksejteken. Az így előállított vegyületek kombinációban történő alkalmazásával
– a kapcsolt hatóanyagoktól függően – a komponensek hatása összeadódhat
(additív hatás) vagy még erősíthetik is egymás hatását (szinergista hatás) a
daganat elpusztításában. Ez az eljárás is azt feltételezi, hogy sokféle
hatóanyag irányító molekula kombinációjára lehet szükség. Reményeink szerint az
előállítandó vegyületkönyvtárak alkalmasak lesznek arra is, hogy ne csak
különböző ráktípusokra fejlesszünk ki hatóanyagot irányító
molekula-konjugátumokat, hanem egy azon daganattípusra több hatékony vegyületet
is készíthessünk az adott elemekből (1. ábra).
Eddig
főleg a rák elpusztítására alkalmas hatóanyagról, illetve az azt célba juttatni
képes, a daganatsejteken lévő receptorokat felismerő, és azokhoz kötődni képes
irányító molekulákról volt szó. Nagyon fontos szerepe van azonban a két
komponenst összekötő bifunkciós linkernek, az összekötő elemnek is. Ennek
biztosítania kell, hogy a kialakított konjugátum stabil maradjon addig, amíg a
vegyület eljut a célzott ráksejtekhez, de bejutva a sejtekbe, a hatóanyag vagy
annak aktív metabolitja fel tudjon szabadulni a konjugátumból. Ez szükséges
általában ahhoz, hogy a gyógyszer kifejthesse tumort pusztító hatását.
Mindehhez az szükséges, hogy mind a hatóanyagon, mind az irányító molekulán
legyen olyan, lehetőleg egymástól eltérő típusú funkciós csoport, amelyik a
linker kétfunkciós csoportjához külön-külön és szelektíven, kovalens kémiai
kötés kialakítása során kapcsolódni tud. A különböző komponensek közötti
kapcsolatról azt érdemes megemlíteni, hogy míg az irányító molekula és a linker
közötti kötésnek nem kell bomlania, így akár egy nagyon stabil kötés (pl.
tioéter-kötés) is lehet, addig a linker és a hatóanyag közötti kötést célszerű
úgy kialakítani, hogy a szabad hatóanyag vagy annak aktív metabolitja
felszabaduljon a ráksejtekben.
Bár,
mint azt látjuk, a konjugátum mindhárom komponense igen fontos szerepet tölt be
a hatóanyag célba juttatásában, és így nem érdemes a hatás szempontjából
kiemelni egyiket sem, talán mégis egy kicsit megkülönböztetett jelentősége van
az irányító molekulának, hisz ez az egység fogja eredményezni a konjugátum
tumor-specifikusságát, ami kezelés során a gyógyszer mellékhatásainak
csökkenését okozza. Ahogy említettük, ezek az irányító molekulák a ráksejteken
a szelektíven vagy nagy mennyiségben előforduló receptorokat ismerik fel. Ezen
receptorok és a hozzájuk kötődni képes ligandumok (pl. peptid hormonok) közül
már sok ismert és folynak is kutatások velük a célzott tumorterápia területén.
Korábban e folyóirat hasábjain már bemutattuk az ezen a területen a
gonadotropin-releasing hormon (GnRH) analógjainak felhasználásával elért
eredményeinket. Azonban érdemes újabb irányító molekulákat is keresni, amelyek
vagy más ráksejteket ismernek fel, vagy ugyanazon daganatsejtek más
receptorait, és így alkalmasak lehetnek a kombinált célzott terápiára. Az
utóbbi időben egyre elterjedtebben használják ilyen célpontok és ligandumaik
feltérképezésére az irányított evolúció egyik fajtáját, az úgynevezett
fágbemutatásos technikát. Ennek a módszernek a nagyon leegyszerűsített vázlatát
mutatja a 2. ábra.

2. ábra. A peptidszekvenciák kiválasztására alkalmas
fágbemutatásos eljárás sematikus bemutatása
A
bakteriofágok olyan vírusok, melyek baktériumokat támadnak meg. Szerkezetük
igen egyszerű, egy külső fehérjeburokból és a benne található örökítő anyagból
épülnek fel. Az eljárás lényege, hogy a vizsgálni kívánt peptidszekvenciákat
kódoló gént a peptid kifejezésére használt bakteriofág génjéhez illesztik, így
ez a peptidszakasz kifejeződik a bakteriofág burokfehérjéjében. Minden egyes
fág egy peptidet fog kifejezni, és a fágban található örökítő anyag tartalmazni
fogja az adott peptidet kódoló nukleinsavat. A felszínükön különböző peptideket
megjelenítő fágok közül szelekciós eljárással lehet a legmegfelelőbbeket
kiválasztani, ami általában kötődési teszten alapul. A fágok felszaporítása
olyan baktériumtörzsekben történik, amiket a fág képes fertőzni. Ha egy hét
aminosavból álló peptidet (heptapeptid) akarunk vizsgálni, figyelembe véve,
hogy a 20 természetes fehérjeépítő aminosavat akarjuk beépíteni minden
pozícióba, akkor 720 klónnal kell számolnunk, ami kb. 109 klónnak felel meg
(ennyi féle heptapeptid állítható elő a 20 aminosav kombinációjából). Azonban a
kiválasztást úgy tervezik, hogy minden fágtípusból több, általában 100–100
legyen kiinduláskor. Ezt a 1011 klónt tartalmazó keveréket hozzák össze a
vizsgálni kívánt típusú tumorsejtekkel. Azok a klónok, amelyek olyan
peptidszekvenciát tartalmaznak, amiket a ráksejteken lévő receptorok
felismernek, azok (különböző erősséggel) kötődnek a sejtekhez, amelyek viszont
nem kötődnek, azt lemossák a sejtekről. Ezután a kötődött klónokat leválasztják
a sejtekről, ezeket felszaporítják baktériumsejtekben, majd egy új ciklusban újra
összehozzák a sejtekkel. Ezt a kikötési és lemosási ciklust 3–5-ször
megismétlik, így a jól kötődő peptidet tartalmazó klónok feldúsulnak a
keverékben. Minél több ciklust végeznek, annál nagyobb valószínűséggel vannak
jelen a jól kötődő tumorszelektív fágok a keverékben. Ezután a megmaradt
fágokból random módon kiválasztanak kb. 50 klónt, és megfelelő módszerekkel (a
fágban található örökítő anyagot szekvenálva) meghatározzák a
nukleinsav-szekvenciát, amiből következtetni tudnak az aminosav-szekevnciára, jelen
esetben a heptapeptid szekvenciájára, amely felismeri az adott típusú
ráksejtet. Azonban a 3–5. szelekciós lépés után is több száz, esetleg több ezer
különböző peptidet tartalmazó klón keveréke van jelen (a szelekciós lépések
számának növekedésével ez a szám csökken). Az összes klónt természetesen nagyon
időigényes és drága lenne végigvizsgálni. Ezért választanak ki limitált számú
(pl. 50) klónt a vizsgálathoz. Ebből persze az következik, hogy lehet, hogy
vannak a keverékben olyan peptideket tartalmazó klónok, amelyek még
hatékonyabban kötődnek a ráksejtekhez, de a véletlenszerű kiválasztás miatt
elveszítjük azokat. Mivel tehát nem biztos, hogy a legmegfelelőbb szekvenciákat
találtuk meg a fágbemutatásos technikával, ezért a kiválasztott peptid szerkezetében
történő változtatásokat érdemes tovább tanulmányozni.
Általában
az oligopeptidekben vannak olyan aminosavak, amelyek jelenléte fontos a
receptorkötődés, vagy a megfelelő térszerkezet kialakítása szempontjából, így
ezek megváltoztatása a hatás elvesztésével járhat. Más aminosavak azonban
módosíthatók a hatás elvesztése nélkül, sőt bizonyos esetekben még fokozható is
a biológiai aktivitás. Ahhoz, hogy megtaláljuk a cserélhető, illetve nem
cserélhető aminosavakat a szekvenciában, a peptidkémikusok az úgynevezett
alanin-szkennelési (Ala scan) módszert alkalmazzák. Ennek során a szekvencia
minden pozíciójában egyenként alaninra cserélik az ott található aminosavat.
Ezek után megvizsgálják, hogy az adott változtatás hatására miként változik a
biológiai aktivitás. Ha azt tapasztalják, hogy a hatás csökken, vagy netalán
meg is szűnik, akkor az azt jelenti, hogy azt az aminosavat nem célszerű
változtatni. Ha azonban a módosítás hatására nem következik be hatáscsökkenés,
esetleg hatásfokozódás tapasztalható, akkor az a pozíció változtatható.
Következő lépésben az így megismert pozícióba más aminosavakat is kipróbálnak
(pozíciós szkennelés), amely során fényt derítenek arra, hogy milyen karakterű
aminosav (savas, bázikus, apoláris, poláris) beépítése szolgáltatja a
leghatékonyabb vegyületet. Az alábbiakban egy, a laboratóriumunkban végzett
kísérlet alapján mutatnánk be ezt a folyamatot.
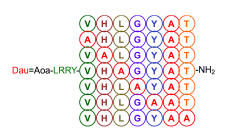
3. ábra. A fágbemutatással kiválasztott és az
alaninszkenneléssel előállított daunomicin–peptid-konjugátumok szerkezetének
sematikus ábrája
Ennek
a hat konjugátumnak ráksejtekre gyakorolt toxikus hatását vizsgáltuk HT-29
sejteken és összehasonlítottuk a kontrollvegyület hatásával (táblázat). Az
eredmények egyértelműen mutatták, hogy a szekvenciában a valin (V), a leucin
(L) és a tirozin (Y) aminosavak cseréje nem megengedett. Ugyanakkor az a
konjugátum, amelyben a glicint (G) cseréltük alaninra (A), hatékonyabban
pusztította a ráksejteket (a kisebb IC50 értékek a nagyobb toxikus hatást
szemléltetik).

Táblázat. A daunomicin–peptidkonjugátumok tumorellenes
hatása

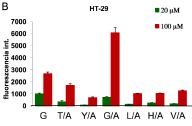
4. ábra. A fágbemutatással kiválasztott és az
alaninszkenneléssel előállított daunomicin–peptid-konjugátumok sejtfelvételének
tanulmányozása áramlási citométerrel. A) Azon sejtek aránya, amelybe bejutott a
konjugátum; B) a bejutott konjugátum mennyiségével arányos fluoreszcencia
intenzitás. (A G az eredeti szekvenciából készült konjugátumot jelenti, míg az
X/A jelölések az adott aminosav X = treonin (T); tirozin (Y); glicin (G);
leucin (L), hisztidin (H); valin (V) alaninra (A) történő cserével előállított
konjugátumot jelenti)

5. ábra. A fágbemutatással kiválasztott és a
glicin/alanin (G/A)-cserével előállított daunomicin–peptidkonjugátumok
sejtfelvételének tanulmányozása fluoreszcens mikroszkóppal 30 perces inkubálás
után. (Az intenzívebb vörös szín, ami a daunomicin színéből adódik, a sejtbe
jutott nagyobb mennyiségű konjugátumot jelenti.)
A
korábbi vizsgálatokhoz hasonlóan végzett kísérletek alapján megállapíthattuk,
hogy a prolin és a lizin beépítése ebbe a pozícióba nem célszerű. A
glutaminsav, szerin, treonin és aszparagin (E, S, T, N) esetében nem
tapasztaltunk szignifikáns változást az alaninnal módosított konjugátum
hatékonyságához képest. Ellenben, ha nagy apoláris oldalláncot tartalmazó
aminosavat fenilalanin vagy leucin (F, L) építettünk be a glicin helyére, akkor
még erősebb tumorellenes hatású konjugátumokhoz jutottunk. Ezeket a hatásbeli
különbségeket szintén igazolni tudtuk a sejtfelvételi adatokkal. Tehát, amelyik
anyag már kis koncentrációban is hatékonyabban bejut a ráksejtekbe, az jobban
pusztítja azokat, míg az a konjugátum (prolint (P) tartalmazó), amely még
magasabb koncentrációban is csak kis mértékben jut be a sejtekbe, az kevéssé
hat a ráksejtekre. Összességében elmondhatjuk, hogy a fágbemutatásos eljárással
kiválasztott peptid felhasználásával készült konjugátumhoz képest egy
nagyságrenddel jobb hatású konjugátumot sikerült előállítanunk.

6. ábra. A pozíciós szkenneléssel előállított
daunomicin–peptidkonjugátumok szerkezetének sematikus ábrája és a konjugátumok
tumorellenes hatása (IC 50 értékek) HT-29 humán vastagbél-tumorsejteken (az
értékek μM-ban értendők)
A
cikkben használt egy- és hárombetűs aminosav-kódok és további rövidítések
jelentése:
alanin:
A (Ala); aszparagin: N (Asn); arginin: R (Arg); glicin: G (Gly); hisztidin: H
(His); leucin: L (Leu); lizin: K (Lys); szerin: S (Ser); fenilalanin: F (Phe);
tirozin: Y (Tyr); treonin: T (Thr); valin: V (Val); aminooxiecetsav (Aoa);
daunomicin (Dau).
Irodalom
Mező,
G. (2011) Célzott tumorterápia peptidekkel. Természet Világa 142, 555-558.
Mező,
G., Hegedüs, R. Szabó, I. (2012) Célzott tumorterápia. Természet Világa 143,
448-451.
Mező,
G., Enyedi K.N. (2015) Egy anyag – két célpont. Lehetőségek a célzott
daganatterápiában. Természet Világa 146, 307-310.
Rivinoja,
A., Laakkonen, P. (2011) Identification of homing peptides using the in vivo
phage display technology. Methods Mol. Biol. 683, 401-415.
Zhang
Y., és mtsai. (2007) Panning and identification of a colon tumor binding
peptide from a phage display peptide library. J. Biomol. Screen. 12, 429-435.
Orbán,
E., Mező, G., és mtsai. (2011) In vitro degradation and antitumor activity of
oxime bond-linked daunorubicin-GnRH-III bioconjugates and DNA-binding
properties of daunorubicin-amino acid metabolites. Amino Acids 41, 469-483.
Kiss,
K., Szabó, R., Mező, G. (2016) Modification of peptide srquence selected for
HT-29 colon cancer cell line by phage display to increase the anti-tumour
activity of conjugates developed for targeted tumour therapy. J Pept. Sci.
22(52S), 183.
| Természet Világa, | 148. évfolyam, 9. szám,
2017. szeptember http//www.termvil.hu/ |